Утро 2го дпп. Нигде не тянет, не болит, ни стреляет. Грудь болит, но она и до переноса болела из-за гормонов. Из поддержки Дюфастон 3 раза, Эстражель 3 раза, Миражель на ночь. За рутинными делами забываю, что у меня был перенос. Да и вообще в этот раз как-то все иначе, как-то спокойно. В прошлые разы хотелось тест сделать уже на 1 дпп. Сейчас во
Что показывает тест, если эмбрион не прикрепляется?
ЭКО мы с мужем сделали после многих лет безуспешных попыток зачать малыша самостоятельно. Врачей я проходила, обследовалась.
У меня была лапароскопия - удаление спаек, хроническое воспаление…
Беременность после лапры не наступила, потом - ГСГ мне удалили трубы и сказали, что зачать я смогу теперь только через ЭКО.
ЭКО - это
Грустить что сорвалась или радоваться что она была?! Тест сейчас на 3 день менструации 😔
Тот момент, когда история не кончается а становится все интереснее 🤪
Девочки,всем добрый вечер.Хелп!Вся уже извелась.Пожалуйста, скажите кто-нибудь, неужели действительно возможно такое,что беременность есть, скажем так недель 6 акушерских ,а тесты все отрицательные.Не знаю что уже думать.ПА один единственный и не защищенный , был месяц назад примерно ,дня через 4 после критических дней.Потом дней через 10 после
Вот в канун Нового года наконец-то и я собралась с силами рассказать свою историю. Может кому-то будет интересно. Сама я, когда со мной это случилось, проводила часы на форумах, читая такие же истории, для того, чтобы хоть немного себя успокоить, что я такая не...
Здравствуйте!
Страдаю бесплодием 6,5 лет, ни дня не сидела на месте, а сейчас можно сказать зашла в тупик.
Когда беременность не наступает...
Когда я познакомилась со своим супругом, я практически сразу поняла что именно от него я хочу двоих мальчиков...
ДЕВОЧКИ-ХОЧУШКИ!
ПРОЧИТАЙТЕ ВСЮ СТАТЬЮ! МНЕ КАЖЕТСЯ , ДЛЯ КАЖДОЙ ОНА ВНЕСЁТ МНОГО-МНОГО ЯСНОСТИ! НЕДАВНО И МНЕ ОНА ОЧЕНЬ ПОМОГЛА)))))))))))))))
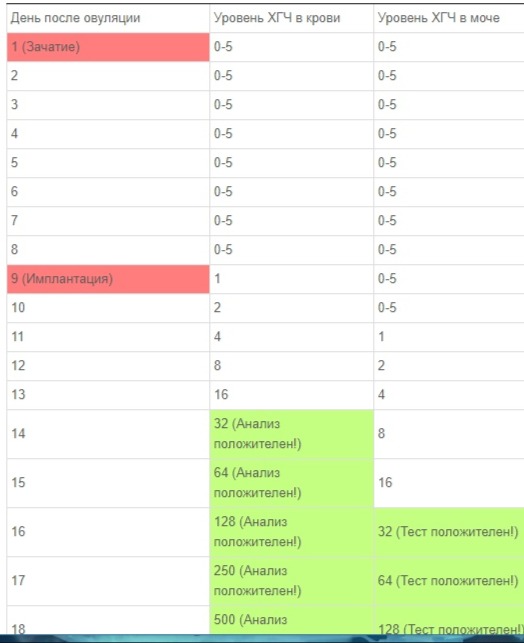
Тесты на беременность. Причины изменений уровня ХГЧ.
Действие теста на определение ранней беременности основано на определении специфического гормона беременности - хорионического гонадотропина (ХГЧ), который начинает вырабатываться через 1 день после имплантации (прикрепления) оплодотворенной яйцеклетки к стенке матки.
Как происходит зачатие?
Созревание яйцеклетки и ее выход из яичника (овуляция) происходит примерно за 14 дней до начала менструации при 28-дневном менструальном цикле.
Оплодотворение этой яйцеклетки возможно примерно в течение 3 - 4 дней. По данным различных авторов, сроки оплодотворения могут быть от 12 - 24 часов до 7 суток. Выживаемость сперматозоидов в женском генитальном тракте зависит во многом от свойств семенной жидкости. Подвижность сперматозоидов сохраняется дольше, чем их способность к оплодотворению.
После оплодотворения яйцеклетка продвигается по маточной трубе в полость матки. Транспортировка зародыша по направлению к матке продолжается в течение 5 - 6 суток. Достигнув полости матки, оплодотворенная яйцеклетка в течение некоторого времени находится в свободном состоянии и на 6 - 7-е сутки внутриутробного периода прикрепляется («прилипает») к эпителию эндометрия, после чего начинает активно внедряться в слизистую матки (имплантируется).
С этого момента начинает развиваться беременность, что и отражается выработкой гормона беременности - хорионического гонадотропина. Таким образом, за несколько дней до ожидаемой менструации, в организме появляются следы ХГЧ, которые можно определить в моче домашними методами с 1-го дня задержки менструации.
В медицинских учреждениях проводят определение ХГЧ в крови, выявляя беременность за несколько дней до срока ожидаемой менструации, т.к. чувствительность «кровяного» метода гораздо выше.
Нормальный уровень ХГЧ в сыворотке крови (мЕд/мл):
Здоровые небеременные 0 - 15
Беременные
1 - 2 нед 19 - 145
2 - 3 нед 111 - 3 640
3 - 4 нед 1 090 - 17 600
4 - 5 нед 2 740 - 59 600
5 - 6 нед 23 500 - 137 000
6 - 7 нед 29 900 - 222 000
7 - 8 нед 30 500 - 266 000
8 - 9 нед 54 700 - 268 000
9 - 10 нед 25 900 - 234 000
10 - 11 нед 46 200 - 238 000
11 - 18 нед 16 500 - 92 700
18 - ... нед 8 540 - 58 500
Внимание! В различных лабораториях нормы могут отличаться.
Механизм «работы» теста на беременность
В тестах на беременность используется иммунохроматография - разновидность хроматографического анализа, основанная на взаимодействии определяемого вещества (обычно белковой природы) с антителами к нему. По такому же принципу взаимодействия антиген-антитело работает иммунная система организма, отсюда и название.
Определяемым веществом служит хорионический гонадотропин человека (ХГЧ) - гликопептидный гормон, выделяемый плацентой в течение беременности. Появление и быстрый рост концентрации ХГЧ в организме (и в частности, в моче) женщины делает его достаточно достоверным признаком беременности. Обычно, на 7-10-й день после оплодотворения, концентрация ХГЧ достигает 25 мМЕ/мл (международных единиц на мл) и удваивается каждые 2-3 дня, достигая максимума между 8-й и 11-й неделями беременности, а затем снижается практически до нуля к началу 3-го триместра. 25 мМЕ/мл - это минимальная концентрация ХГЧ, детектируемая с помощью иммунохроматографических тестов.
Тест-полоска содержит конъюгат (непрочное соединение) антител к ХГЧ с красителем. Когда образец мочи движется по абсорбирующей полоске, конъюгат связывается с ХГЧ и образует комплекс антиген-антитело. В зоне положительной реакции ("беременная полоска") комплекс связывается с анти-ХГЧ-антителами. При этом высвобождается краситель и образуется красно-розовая полоска. Если ХГЧ в образце отсутствует, никакой полоски, понятно, не образуется. Тем временем моча движется дальше, минует зону положительной реакции и достигает зоны отрицательной реакции ("контрольная полоска"). Там несвязанный конъюгат антитело-краситель связывается реагентами контрольной полоски, высвобождается краситель и образуется вторая (контрольная) полоска такого же красно-розового цвета. Все реакции происходят в течение 3-5, реже 7 мин.
В не слишком качественных тестах краситель может отщепляться от конъюгата раньше, чем весь комплекс антитело-ХГЧ-краситель достигнет реакционных зон, образуя расплывчатые пятна. Они-то чаще всего и принимаются за "ложноположительный" результат. Настоящие ложноположительные результаты встречаются гораздо реже и вызваны вполне конкретными причинами. Также слабая вторая полоска может проявиться, если "передержать" тест, т.е. считывать показания не через указанные на упаковке 5 минут, а позже. Такая линия возникает в результате испарения воды с поверхности теста, от чего разрушаются конъюгаты и высвобождается краситель. Так что не стоит ждать 10 мин вместо 5, чтобы "уж точно убедиться".
Поскольку точно выполнить все инструкции и правильно интерпретировать результаты теста может не каждая женщина, врачи, особенно старой закалки, не склонны доверять тестам.
Что определяет тест на беременность?
Тест на беременность определяет хорионический гонадотропин человека (ХГЧ) - гормон, выделяемый плацентой с момента имплантации эмбриона в стенку матки в течение всей беременности. Достоверность этого теста весьма высокая - нет плаценты, нет и ХГ. ХГЧ можно определять как в крови (в лаборатории), так и в моче (в лаборатории и дома)
На какой день после овуляции можно проводить тест?
В принципе, положительный результат можно получить уже на 7-й день после овуляции. На имплантацию эмбриона нужно 6-12 дней, обычно около 10 дней. Так что имеет смысл подождать 10-12 дней после овуляции, но даже и в этом случае часто бывают ложноотрицательные результаты (т.е., беременность есть, но тест отрицательный).
Тесты разных производителей имеют различную чувствительность, большинство из них рассчитаны на использование с 1-го дня задержки месячных. В 90% ± 5% случаев к этому времени эмбрион уже имплантируется в стенку матки и начинает вырабатывать ХГЧ. Однако в 10% случаев имплантации еще не произошло. При задержке в 1 неделю имплантация происходит уже в 97% ± 3% случаев. Однако на практике достоверность тестов ограничена их чувствительностью, так что реальная достоверность несколько ниже. Поскольку уровень ХГЧ удваивается каждые 2-3 дня, отсюда следует рекомендация: при отрицательном результате, если месячные не начнутся, повторить тест через несколько дней.
Что означают ложноположительные и ложноотрицательные результаты теста?
Ложноположительный результат - это когда тест показывает две полоски в отсутствие беременности. Так бывает, когда женщина принимает препараты, содержащие ХГЧ, а также при трофобластических опухолях. После самопроизвольного выкидыша или аборта на ранних сроках или удаления внематочной беременности ХГЧ в течение некоторого времени остается в организме, и тест дает ложноположительные результаты (т.е. беременности уже нет, а тест еще положительный). Как и в случае приема препаратов, содержащих ХГЧ, для получения достоверных результатов необходимо сделать два количественных определения ХГЧ с интервалом в 2-3 дня. Уменьшение уровня ХГЧ свидетельствует о том, что беременности уже нет. Таким образом, ложноположительные результаты - относительная редкость, в отличие от ложноотрицательных. Последние получаются тогда, когда срок беременности еще слишком мал и уровень ХГЧ слишком низок, чтобы его обнаружил тест (либо тест сам по себе недостаточно чувствительный).
Достоверность домашнего теста зависит от различных причин:
- Качество самого теста. Продукция разных фирм может значительно различаться.
- Срок годности теста, условия и место его хранения. Считается, что в большинстве случаев тесту можно доверять при условии, что он куплен в аптеке.
- Состояние беременности. При беременности, находящейся на грани выкидыша, ХГ будет вырабатываться гораздо меньше, чем при нормально развивающейся беременности.
- Условия постановки теста: исследование необходимо проводить, используя утреннюю порцию мочи, в которой наблюдается максимальное содержание гормона; оценку теста необходимо проводить, придерживаясь временного интервала, указанного в инструкции.
- Дополнительные обстоятельства. На содержание ХГ в моче влияет рацион и функциональное состояние ваших почек.
- Если накануне вечером вы выпили очень много жидкости или съели арбуз, или принимаете диуретики (мочегонные средства), концентрация гормонов в моче будет слишком низкой, и тест их "не заметит".
- Если у вас в моче присутствует белок (даже если вы об этом ничего не знаете) - тест может дать неправильный результат.
- Если вам вводили ХГЧ с целью индукции овуляции (препараты Профази, Прегнил) или для поддержания лютеиновой фазы, то следы этого гормона могут оставаться в вашем организме в течение 10 дней после последнего приёма препарата, и, соответственно, тест на беременность может дать ложноположительный результат.
- Также уровень ХГЧ может определяться через несколько недель после нормальных родов, кесарева сечения, спонтанного или медицинского аборта и в других случаях, указанных выше.
В результате можно получить неверную информацию, причем в обе стороны: беременности нет, но тест вроде бы положительный. Или: беременность есть, но тест пока отрицательный. И то, и другое бывает источником больших переживаний.
ТЕРПЕНИЯ ВАМ МОИ ХОРОШИЕ И ОГРОМНОЙ УДАЧИ)))))))
ААААААААППППППППППЧЧЧЧЧЧЧЧЧХХХХХХХИИИИИИИИИИИ!!!!!
Мое второе эко (дата вступления в протокол) 16.06, после первой неудачи (дата вступления в протокол) 17.04. Вторая стимуляция. Все по новой. Другой ре. Другая больница. Друг

Выделения из влагалища - это вполне нормально. Они могут появляться время от времени у каждой женщины. Все зависит от конкретной ситуации, состояния здоровья или определенного периода. Иногда выделения могут свидетельствовать даже о наступлении беременности. В основном это прозрачные, негустые выделения без какого-то определенного запаха, и, что самое главное, без зуда. Все дело в том, что при беременности у женщины начинает расти уровень эстрогена, поэтому среда, которая образовывается, может быть подходящей для грибковой инфекции, к примеру, молочницы. Если у вас появились выделения, и вы при этом испытываете дискомфорт, немедленно обратитесь к своему гинекологу, не затягивайте!
Что такое «норма выделений» при беременности?
Медики называют «норма выделения» на ранней стадии беременности, если они слизистые и похожи по консистенции на яичный белок - как раз как во время второй фазы менструации. Врачи объясняют это тем, что слизистая половых органов способна вырабатывать выделения не только для защиты, но и для обеспечения других функций. Взять хотя бы то, что без нее сперматозоид не смог бы продвигаться по направлению к яйцеклетке.
Во время беременности организм перестраивается - особенно это отражается на гормональном фоне. Именно поэтому при густых, непрозрачных и вязких выделениях не стоит паниковать, ведь все это из-за гормона прогестерона, благодаря которому зародыш прикрепляется, а затем начинает формироваться плацента. Ко всему прочему, именно эти выделения и формируют слизистую пробку, закрывающую вход в матку - она, к тому же, способна отлично защитить будущего малыша от инфекции, которая моет попасть из внешнего мира. Если выделения слишком обильные или вязкие, то можно пользоваться прокладками.
Что такое имплантационное кровотечение
В первом триместре беременности цвет выделений может варьироваться от желтого до коричневого. Если женщина не подозревает о своем положении, то выделения она может расценивать, как наступление менструации. На самом деле это может быть имплантационное кровотечение - оно свидетельствует о том, что эмбрион прикрепляется к стенке матки. В основном этот период приходится на 6-12 день после зачатия - как раз перед тем, когда должна начаться менструация.
Могут ли выделения появляться время от времени? Иногда так бывает, когда повышается активность плодного яйца. При этом нередко женщина испытывает боль или спазмы. Имплантационное кровотечение может быть кремообразной консистенции, а его цвет варьируется от желтого до розового. Тем не менее, не стоит забывать, что это также может быть признаком эрозии шейки матки - она способна усилиться при наступлении беременности.
Выделения, которые являются признаком беременности
Прежде всего, запомните, что выделения, которые являются признаком наступления беременности, никогда не будут похожи на обычную менструацию.
Во-первых, они не такие обильные.
Во-вторых, они никогда не будут темно-красного или коричневого цвета.
В-третьих, у них полное отсутствие динамики.
Именно поэтому, если вместо привычной менструации у вас «странные» выделения - сделайте тест на беременность, возможно, вы скоро испытаете радость материнства.
Если тест на беременность показывает положительный результат, а после выделений, которые были описаны выше, у вас началась якобы обычная менструация, немедленно обратитесь к врачу, так как это может быть признаком какой-то патологии.
Вот решила для истории записать в дневник всю хронологию событий, переживаний, эмоций. Ну, начнём!
После неудачного протолкала и медикаментозного аборта на 25ДПП 14.10.2018г. прошло лишь 2 цикла и мои врачи РЕ и ГИ сказали что я готова к следующей попытк...
Тесты на беременность. Причины изменений уровня ХГЧ
Действие теста на определение ранней беременности основано на определении специфического гормона беременности - хорионического гонадотропина (ХГЧ), который начинает вырабатываться через 1 день после имплантации (прикрепления) оплодотворенной яйцеклетки к стенке матки.
Как происходит зачатие? Созревание яйцеклетки и ее выход из яичника (овуляция) происходит примерно за 14 дней до начала менструации при 28-дневном менструальном цикле.
Оплодотворение этой яйцеклетки возможно примерно в течение 3 - 4 дней. По данным различных авторов, сроки оплодотворения могут быть от 12 - 24 часов до 7 суток. Выживаемость сперматозоидов в женском генитальном тракте зависит во многом от свойств семенной жидкости. Подвижность сперматозоидов сохраняется дольше, чем их способность к оплодотворению.
После оплодотворения яйцеклетка продвигается по маточной трубе в полость матки. Транспортировка зародыша по направлению к матке продолжается в течение 5 - 6 суток. Достигнув полости матки, оплодотворенная яйцеклетка в течение некоторого времени находится в свободном состоянии и на 6 - 7-е сутки внутриутробного периода прикрепляется («прилипает») к эпителию эндометрия, после чего начинает активно внедряться в слизистую матки (имплантируется).
С этого момента начинает развиваться беременность, что и отражается выработкой гормона беременности - хорионического гонадотропина. Таким образом, за несколько дней до ожидаемой менструации, в организме появляются следы ХГЧ, которые можно определить в моче домашними методами с 1-го дня задержки менструации.
В медицинских учреждениях проводят определение ХГЧ в крови, выявляя беременность за несколько дней до срока ожидаемой менструации, т.к. чувствительность «кровяного» метода гораздо выше.
Нормальный уровень ХГЧ в сыворотке крови (мЕд/мл):
Здоровые небеременные 0 - 15
Беременные
1 - 2 нед 19 - 145
2 - 3 нед 111 - 3 640
3 - 4 нед 1 090 - 17 600
4 - 5 нед 2 740 - 59 600
5 - 6 нед 23 500 - 137 000
6 - 7 нед 29 900 - 222 000
7 - 8 нед 30 500 - 266 000
8 - 9 нед 54 700 - 268 000
9 - 10 нед 25 900 - 234 000
10 - 11 нед 46 200 - 238 000
11 - 18 нед 16 500 - 92 700
18 - ... нед 8 540 - 58 500
Внимание! В различных лабораториях нормы могут отличаться.
Механизм «работы» теста на беременностьВ тестах на беременность используется иммунохроматография - разновидность хроматографического анализа, основанная на взаимодействии определяемого вещества (обычно белковой природы) с антителами к нему. По такому же принципу взаимодействия антиген-антитело работает иммунная система организма, отсюда и название.
Определяемым веществом служит хорионический гонадотропин человека (ХГЧ) - гликопептидный гормон, выделяемый плацентой в течение беременности. Появление и быстрый рост концентрации ХГЧ в организме (и в частности, в моче) женщины делает его достаточно достоверным признаком беременности. Обычно, на 7-10-й день после оплодотворения, концентрация ХГЧ достигает 25 мМЕ/мл (международных единиц на мл) и удваивается каждые 2-3 дня, достигая максимума между 8-й и 11-й неделями беременности, а затем снижается практически до нуля к началу 3-го триместра. 25 мМЕ/мл - это минимальная концентрация ХГЧ, детектируемая с помощью иммунохроматографических тестов.
Тест-полоска содержит конъюгат (непрочное соединение) антител к ХГЧ с красителем. Когда образец мочи движется по абсорбирующей полоске, конъюгат связывается с ХГЧ и образует комплекс антиген-антитело. В зоне положительной реакции ("беременная полоска") комплекс связывается с анти-ХГЧ-антителами. При этом высвобождается краситель и образуется красно-розовая полоска. Если ХГЧ в образце отсутствует, никакой полоски, понятно, не образуется. Тем временем моча движется дальше, минует зону положительной реакции и достигает зоны отрицательной реакции ("контрольная полоска"). Там несвязанный конъюгат антитело-краситель связывается реагентами контрольной полоски, высвобождается краситель и образуется вторая (контрольная) полоска такого же красно-розового цвета. Все реакции происходят в течение 3-5, реже 7 мин.
В не слишком качественных тестах краситель может отщепляться от конъюгата раньше, чем весь комплекс антитело-ХГЧ-краситель достигнет реакционных зон, образуя расплывчатые пятна. Они-то чаще всего и принимаются за "ложноположительный" результат. Настоящие ложноположительные результаты встречаются гораздо реже и вызваны вполне конкретными причинами. Также слабая вторая полоска может проявиться, если "передержать" тест, т.е. считывать показания не через указанные на упаковке 5 минут, а позже. Такая линия возникает в результате испарения воды с поверхности теста, от чего разрушаются конъюгаты и высвобождается краситель. Так что не стоит ждать 10 мин вместо 5, чтобы "уж точно убедиться".
Поскольку точно выполнить все инструкции и правильно интерпретировать результаты теста может не каждая женщина, врачи, особенно старой закалки, не склонны доверять тестам.
Что определяет тест на беременность?Тест на беременность определяет хорионический гонадотропин человека (ХГЧ) - гормон, выделяемый плацентой с момента имплантации эмбриона в стенку матки в течение всей беременности. Достоверность этого теста весьма высокая - нет плаценты, нет и ХГ. ХГЧ можно определять как в крови (в лаборатории), так и в моче (в лаборатории и дома)
На какой день после овуляции можно проводить тест? В принципе, положительный результат можно получить уже на 7-й день после овуляции. На имплантацию эмбриона нужно 6-12 дней, обычно около 10 дней. Так что имеет смысл подождать 10-12 дней после овуляции, но даже и в этом случае часто бывают ложноотрицательные результаты (т.е., беременность есть, но тест отрицательный).
Тесты разных производителей имеют различную чувствительность, большинство из них рассчитаны на использование с 1-го дня задержки месячных. В 90% ± 5% случаев к этому времени эмбрион уже имплантируется в стенку матки и начинает вырабатывать ХГЧ. Однако в 10% случаев имплантации еще не произошло. При задержке в 1 неделю имплантация происходит уже в 97% ± 3% случаев. Однако на практике достоверность тестов ограничена их чувствительностью, так что реальная достоверность несколько ниже. Поскольку уровень ХГЧ удваивается каждые 2-3 дня, отсюда следует рекомендация: при отрицательном результате, если месячные не начнутся, повторить тест через несколько дней.
Что означают ложноположительные и ложноотрицательные результаты теста?Ложноположительный результат - это когда тест показывает две полоски в отсутствие беременности. Так бывает, когда женщина принимает препараты, содержащие ХГЧ, а также при трофобластических опухолях. После самопроизвольного выкидыша или аборта на ранних сроках или удаления внематочной беременности ХГЧ в течение некоторого времени остается в организме, и тест дает ложноположительные результаты (т.е. беременности уже нет, а тест еще положительный). Как и в случае приема препаратов, содержащих ХГЧ, для получения достоверных результатов необходимо сделать два количественных определения ХГЧ с интервалом в 2-3 дня. Уменьшение уровня ХГЧ свидетельствует о том, что беременности уже нет. Таким образом, ложноположительные результаты - относительная редкость, в отличие от ложноотрицательных. Последние получаются тогда, когда срок беременности еще слишком мал и уровень ХГЧ слишком низок, чтобы его обнаружил тест (либо тест сам по себе недостаточно чувствительный).
Достоверность домашнего теста зависит от различных причин:
- Качество самого теста. Продукция разных фирм может значительно различаться.
- Срок годности теста, условия и место его хранения. Считается, что в большинстве случаев тесту можно доверять при условии, что он куплен в аптеке.
- Состояние беременности. При беременности, находящейся на грани выкидыша, ХГ будет вырабатываться гораздо меньше, чем при нормально развивающейся беременности.
- Условия постановки теста: исследование необходимо проводить, используя утреннюю порцию мочи, в которой наблюдается максимальное содержание гормона; оценку теста необходимо проводить, придерживаясь временного интервала, указанного в инструкции.
- Дополнительные обстоятельства. На содержание ХГ в моче влияет рацион и функциональное состояние ваших почек.
- Если накануне вечером вы выпили очень много жидкости или съели арбуз, или принимаете диуретики (мочегонные средства), концентрация гормонов в моче будет слишком низкой, и тест их "не заметит".
- Если у вас в моче присутствует белок (даже если вы об этом ничего не знаете) - тест может дать неправильный результат.
- Если вам вводили ХГЧ с целью индукции овуляции (препараты Профази, Прегнил) или для поддержания лютеиновой фазы, то следы этого гормона могут оставаться в вашем организме в течение 10 дней после последнего приёма препарата, и, соответственно, тест на беременность может дать ложноположительный результат.
- Также уровень ХГЧ может определяться через несколько недель после нормальных родов, кесарева сечения, спонтанного или медицинского аборта и в других случаях, указанных выше.
В результате можно получить неверную информацию, причем в обе стороны: беременности нет, но тест вроде бы положительный. Или: беременность есть, но тест пока отрицательный. И то, и другое бывает источником больших переживаний.
1-я неделя беременности:
• Самое время отказаться от вредных привычек
• К концу недели на УЗИ уже можно выявить доминатный фолликул
Способность к имплантации является одной из основных интегральных характеристик оценки качества эмбрионов в программе ЭКО. Показано, что наибольшая частота наступления имплантации и беременности наблюдается при переносе эмбрионов с ранним наступлением первого деления и быстрыми темпами дробления; имеющих более 7 бластомеров одинаковой формы и равного размера и наличием не более 15% цитоплазматических фрагментов на 3-й день наблюдения. Одним из важнейших критериев отбора эмбрионов для последующего переноса в полость матки является их способность к формированию бластоцисты. Перенос эмбриона в стадии бластоцисты позволяет увеличить частоту наступления беременности до 50-60% случаев на эмбриоперенос.
Недостаточность лютеиновой фазы (НЛФ) менструального цикла, по данным функциональной, ультразвуковой диагностики и определения уровня прогестерона, во вторую фазу менструального цикла диагностирована у 161 женщины. Из них функциональ ная гиперпролактинемия (ГП+НЛФ) без нарушения функции щитовидной железы выявлена у 57 пациенток, смешанная гиперандрогения (ГАГ+НЛФ) - у 30, сочетание гиперандрогении и гиперпролактинемии (ГАГ+ГП+НЛФ) - у 5. Наружный генитальный эндометриоз, в основном I-III степени тяжести в сочетании с НЛФ (ЭНД+НЛФ) диагностирован у 36 больных.
Отдельную группу составили 11 женщин с синдромом поликистозных яичников (СПКЯ) и хронической ановуляцией.
Для анализа отобраны лечебные циклы пар, у которых при двукратном исследовании эякулята полового партнера подтверждена нормоспермия.
Стимуляцию суперовуляции во всех лечебных циклах осуществляли с использованием препаратов а-ГнРГ (декапептил-дейли) в сочетании с чМГ (хумегон, меногон). В качестве индуктора овуляции использовали прегнил (10 000 МЕ). Начиная с 21-го дня менструального цикла, предшествующего стимуляции, с целью коррекции гормонального статуса и улучшения результатов лечения 15 пациенткам из группы ГАГ+ НЛФ назначали дексаметазон в дозе 0,5 мг 1 раз в сутки, до дня ультразвуковой диагностики беременности.
Дексаметазон достоверно увеличивал количество выношенных беременностей в группе ГАГ+НЛФ (p<0,05).
Как повысить шансы на успех программы ЭКО?
Средний процент успешно завершенных циклов экстракорпорального оплодотворения (ЭКО) вычислить непросто. Вероятность беременности после ЭКО зависит прежде всего от диагноза пары. Разумеется, большое значение имеет оптимальность назначенного курса лечения бесплодия и уровень профессионализма врачей клиники ЭКО. Средний показатель успешных программ ЭКО составляет примерно 35-40%.
Существует несколько действенных методов повышения шансов на успех ЭКО, рекомендуемых репродуктологами.
Подсадка бластоцист. На сегодняшний момент большинство врачей склоняются к тому, что бластоциста (5-6-дневный эмбрион) является оптимальной для переноса формой зародыша. При лечении бесплодия методами вспомагательных репродуктивных технологий (ВРТ) частота успешной имплантации бластоцисты в матку составляет 50%, у трехдневных эмбрионов - 25%. Еще важным является то, на трехдневной стадии развития собственный геном эмбриона неактивен, зародыш развивается за счет яйцеклетки. Таким образом, если в геноме имеются отклонения - эмбрион остановится в развитии после переноса в матку. При подсадке бластоцисты этот «блок развития» зародыш преодолевает в пробирке, что повышает вероятность успешного развиваться в организме матери. По наблюдениям репродуктологов, в случае подсадки бластоцист внематочные беременности, выкидыши и замершие беременности случаются значительно реже. Однако не все клиники ЭКО могут предложить паре перенос бластоцист. Для осуществления такого переноса нужна «сильная» эмбриология, наличие особых сред для бластоцист и специальные катетеры для переноса.
Лазерный хэтчинг. На 6-7 день развития эмбрион прикрепляется к стенке матки. Для того, чтобы этот процесс прошел успешно, эмбрион сначала должен «вылупиться» из своей оболочки. В случае, когда оболочка слишком толстая либо у эмбриона недостаточно ферментов для ее расщепления, беременность не наступает. Замечено, что чем больше возраст женщины, тем толще и плотнее оболочка эмбриона, что приводит к более низкой вероятности вылупления эмбриона и прикрепления его к стенке матки. Для облегчения этого процесса и увеличения вероятности наступления беременности, используется вспомогательный хэтчинг. В современных клиниках ЭКО для хетчинга используются лазерные лучи, которые истончают оболочку, обусловливая легкое освобождение от нее зародыша.
Современные клиники ЭКО учитывают факторы влияния подсадки бластоцист и лазерного хэтчинга на наступление беременности после ЭКО. Таким образом, для повышения вероятности успешного ЭКО, лечение бесплодия предусматривает кроме непосредственно ЭКО, такие возможности, как ИКСИ, выращивание эмбриона до стадии бластоцисты (5-е сутки развития), замораживание эмбрионов, вспомогательные лазерные «насечки» на оболочке эмбриона (хэтчинг), циклы переноса криоконсервированных эмбрионов соответственно их количеству и медикаменты, необходимые для стимуляции овуляции. Благодаря этому комплексу процедур вероятность положительного исхода ЭКО повышается до 75-80%, тогда как при обычном искусственном оплодотворении беременность наступает только в 35-40% случаев.
Стимуляция с помощью ФСГ начинается сразу после прекращения приема противозачаточных препаратов и антагонист добавляется, когда фолликулы достигают определенного размера (около 14 мм). Это лекарство помогает предотвратить преждевременную овуляцию.
- Целью стимуляции яичников является получение хотя бы двух фолликулов размерами 15-18 мм. Когда анализы крови и УЗИ показывают, что фолликулы "готовы", нужно сделать инъекцию ХГТ (хорионический гонадотропин - Ovidrel®, Pregnyl®, Novarel®). ХГТ обычно вводится подкожно в определенное время вечером. Это позволяет фолликулам подготовится к забору яйцеклеток около 36 часов позднее.
Побочные эффекты лечения. Инъекции ФСГ, сами по себе, не вызывают побочных явлений. Однако вследствие лечения яичники увеличиваются в размерах, что может вызывать вздутие живота, и дискомфорт, а в более тяжелых случаях тошноту и даже рвоту.
Синдром гиперстимуляции яичников это состояние, которое проявляется чрезмерным увеличением яичников и вздутием живота. Женщина может жаловаться на сильные боли в животе, рвоту. А в случае отсутствия лечения могут образовываться сгустки крови, перекрывающие сосуды нижних конечностей или легких, а также нарушения баланса жидкостей в организме. Легкие формы этого синдрома случаются у 2-6% женщин получающих лечения для индукции овуляции. Тяжелые формы синдрома гиперстимуляции яичников возможны в примерно 1% случаев.
Риск развития этого осложнения может быть снижен прекращением курса ЭКО при чрезмерном повышении уровня эстрогена в крови или если на УЗИ определяется слишком большое количество фолликулов. Цикл экстракорпорального оплодотворения может быть прекращен до введения ХГТ или после забора яйцеклеток. Если лечение прервано после изъятия яйцеклеток, то они обычно оплодотворяются и замораживаются для использования в последующем цикле. Так как симптомы синдрома гиперстимуляции яичников максимально выражены на 3-5 день после извлечения яйцеклеток, то решение о заморозке эмбрионов может быть отложено на этот срок.
Забор яйцеклеток. Примерно через 32 - 36 часов после введения ХГТ проводится процедура забора яйцеклеток. Врач вводит датчик УЗИ во влагалище и затем использует специальную иглу для извлечения яйцеклеток из фолликулов. Процедура занимает от 15 до 30 минут, в зависимости от количества фолликулов, и проводится под воздействием успокаивающих лекарств.
Серьезные осложнения при извлечении яйцеклеток случаются редко, но возможны побочные явления, такие как, боли в области малого таза, небольшое кровотечение и вагинальные выделения. При появлении побочных явлений нужно немедленно связаться с лечащим врачом. Вздутие живота и дискомфорт могут быть также признаками синдрома гиперстимуляции яичников.
После забора яйцеклеток женщина остается под наблюдением несколько часов, и если нет осложнений, может уйти домой. Рекомендуется воздержаться от вождения машины или работы в течение 24 часов.
Оплодотворение. После извлечения яйцеклеток они смешиваются со спермой в лабораторных условиях, и происходит оплодотворение. Обычно, оплодотворяются около 50% яйцеклеток.
В случаях выраженной патологии спермы (бесплодие вследствие мужского фактора) оплодотворение производится путем интрацитоплазматического введения спермы - прямого введения сперматозоида в яйцеклетку под контролем микроскопа. Оплодотворение достигается в 50-70%.
Перенос эмбрионов. Примерно через 2-5 дней после забора одна или более яйцеклетки помещаются в матку женщины с помощью тонкого, гибкого катетера, вводимого через шейку матки. Некоторые женщины могут испытывать небольшие боли во время процедуры. Анестезия обычно не требуется.
После проведения процедуры рекомендуется домашний отдых в течение нескольких часов. Хотя исследования не подтверждают, что покой повышает вероятность наступления беременности, большинство женщин предпочитают отдых.
Большинство врачей рекомендуют прием препаратов прогестерона для увеличения шансов имплантации эмбриона в полости матки. Прием лекарства начинается или в день забора или в день возврата яйцеклеток. Лекарство назначается в виде вагинального геля или свечи или же в виде внутримышечной инъекции.
Каково оптимальное количество эмбрионов для пересадки? Количество эмбрионов, пересаживаемых женщине, зависит от ее гинекологической истории (беременности, аборты), возраста, качества эмбрионов и желания супружеской пары. Молодым женщинам (до 35 лет) во время первого цикла экстракорпорального оплодотворения рекомендуется перенос одного или двух эмбрионов. Если повторные попытки ЭКО не приносят результатов, врач может рекомендовать перенос большего количества эмбрионов для повышения шанса забеременеть. Однако, это может увеличить вероятность многоплодной беременности (двойня, тройня).
Вероятность имплантации эмбрионов снижается у женщин старше 40 лет, в результате требуется большее количество эмбрионов (до 5). Однако, у женщин, получающих яйцеклетки от молодых доноров, вероятность забеременеть такая же, как у молодых женщин и обычно рекомендуется перенос только одного или двух эмбрионов.
Хранение неиспользованных эмбрионов. Эмбрионы, которые не были пересажены, могут быть сохранены в замороженном виде (криоконсервация). Так как некоторые эмбрионы погибают в процессе оттаивания, то шансы на успешную беременность при использовании замороженных эмбрионов обычно ниже.
Эмбрионы могут быть заморожены на неограниченный период времени. Однако, обычно предлагается несколько вариантов
- хранение эмбрионов для переноса в более позднее время
- передача эмбрионов для научных исследований или для использования другой парой («усыновление эмбрионов»)
- утилизация
Проверка на беременность после искусственного оплодотворения.
Анализ крови. Приблизительно через две недели после переноса эмбрионов можно провести анализ крови или мочи на наличие ХГТ (хорионического гонадотропина), гормона, который подтверждает наличие беременности. Тест на беременность в домашних условиях недостаточно чувствительный для определения беременности на ранних сроках, по сравнению с анализом крови.
- Если первый анализ крови на ХГТ <5 МЕ/Л, то женщина не беременна
- Если первый анализ крови на ХГТ > 10 МЕ/Л, то тест повторяют через 48 часов, чтобы подтвердить повышение уровня гормона. Уровень ХГТ примерно удваивается каждые 48 часов в течение первых 21 дня после переноса эмбриона.
- Если во втором тесте уровень ХГТ не удваивается, то анализ может быть повторен еще через 48 часов. В этом случае, в зависимости от ситуации, может идти речь о нежизнеспособной беременности. Уровни ХГТ не увеличиваются, или уменьшаются, когда есть проблемы в развитии беременности.
УЗИ. Если уровень ХГТ увеличивается, как и ожидалось, то через три-четыре недели после переноса можно провести тазовое ультразвуковое исследование. На этом этапе, как правило, уже можно определить наличие плодного мешка в матке. Плодный мешок - это полость, заполненная жидкостью, в которой находится эмбрион.
На пятой-шестой неделе беременности (четыре-пять недель после переноса эмбрионов) можно определить желточный мешок, который обеспечивает питание эмбриона на ранних стадиях развития. Сердцебиение обычно можно увидеть на 6-6.5 неделе беременности (5-5.5 неделя после процедуры ЭКО).
Наблюдение за беременностью. В большинстве случаев наблюдение начинается на 6-10 неделе беременности. В этот период рекомендуется начать регулярные визиты к гинекологу.
В случае неудачного ЭКО. Вероятность забеременеть при проведении экстракорпорального оплодотворения достаточно высока. В общем, около 27% циклов ЭКО заканчиваются беременностью и родами, и суммарная вероятность забеременеть увеличивается при проведении повторных процедур.
Однако, индивидуальные шансы на успех зависят от многих факторов, включая возраст женщины, причину бесплодия и метода лечения. Для примера, в Израиле вероятность живых родов для каждого цикла ЭКО составляет около 30-35% в возрасте до 35 лет, 25% у женщин в возрасте 35-37 лет, 15-20% в возрасте 38-40 лет и 6-10% у женщин старше 40 лет.
План обследования включает: • исключение хронического эндометрита - проведение аспирационной биопсии эндометрия с последующим морфологическим и иммуногистохимическим исследованием для определения рецептивности эндометрия, т.е. чувствительности эндометрия к имплантации• Определение гормонального профиля
- ФСГ (фолликулостимулирующий гормон),
ЛГ (лютеинизирующий гормон),
Пролактин,
Эстрадиол,
17-OH-прогестерон,
Андростендион,
Андростендиол глюкуронид,
ДГЭА-сульфат (дегидроэпиандростерон сульфат),
Тестостерон общий,
Тестостерон свободный,
Дигидротестостерон,
ГСПГ (глобулин, связывающий половые гормоны)
• Определение показателей гормонов щитовидной железы
- ТТГ (тиреотропный гормон), Т4 (тироксин),
Т3 (трийодтиронин),
Анти-ТГ (антитела к тиреоглобулину),
Анти-ТПО (антитела к микросомальной тиреопероксидазе),
Тиреоглобулин
• Исследование на биоценоз влагалища и посев на флору отделяемого из половых органов с определением чувствительности к основному спектру антибиотиков и бактериофага
• Инфекции, передающиеся половым путем
хламидиоз,
микоплазмоз,
уреаплазмоз,
трихомониаз,
герпес,
вирус паппиломы человека.
• Показатели гемостаза
Фибриноген,
Протромбин,
Тромбиновое время,
АЧТВ,
Антитромбин III,
Волчаночный антикоагулянт,
Д-димер,
Протеин-С
• Исследование TORCH-комплекса
• Определение генетического риска нарушения системы свертывания крови (FGB, F2, F5, SERPINE1, ITGA2, ITGB3)
• Выявление антифосфолипидного синдрома
- АФС- (определение антитела класса IgМ и IgG к фосфолипидам: кардиолипину, фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте).
• Определение генетического дефекта ферментов фолатного цикла
(MTHFR, MTR, MTRR)
• Генотипирование супружеской пары, HLA II класс (локусы DRB1, DQA1, DQB1)
Нарушение большинства из указанных параметров могут способствовать нарушению чувствительности слизистой оболочки матки к имплантации эмбриона и соответственно приводить к бесплодию и невынашиванию беременности на крайне ранних сроках.
Состояние проблемы.Место методов вспомогательных репродуктивных технологий в лечении бесплодия
Основным диагностическим критерием оценки состояния эндометрия при 2D ТВЭ является его толщина. Эхографическая толщина эндометрия отображает степень подготовки эндометрия эстрогенами. Доказано, что в случаях, когда толщина эндометрия менее 5 мм, имплантация не происходит и перенос эмбрионов лучше не производить. В литературе описаны лишь единичные случаи наступления беременности, когда толщина эндометрия в циклах ЭКО была менее 5 мм.Толщина эндометрия в пределах 5-7 мм является субоптимальной, то есть имплантация возможна, но ее вероятность низка по сравнению с толщиной эндометрия выше 7 мм. Идеальной толщиной эндометрия считается 9-12 мм. Часть исследователей отмечает лучший прогноз ЭКО-программ в случаях, когда толщина эндометрия не более 10 мм, в работах других авторов это не нашло подтверждения. Эхогенность эндометрия изменяется на протяжении менструального цикла. В фазе пролиферации эндометрий имеет так называемую трехлинейную - С-структуру. Повышение эхогенности эндометрия (В- и А-структура) в день назначения разрешающей дозы хорионического гонадотропина (ХГ) ассоциируется с низкой вероятностью имплантации, плохим прогнозом наступления беременности.
Классическими критериями зрелости фолликулов в циклах ЭКО при эхографии являются размер фолликулов и/или их объем. Считается, что при наличии 2-4 доминантных фолликулов от 16 до 22 мм можно назначать триггерную дозу хорионического гонадотропина.
В последние годы с целью мониторинга циклов ЭКО начали применять допплерографию. Кровоток в маточных артериях был впервые использован как маркер рецептивности эндометрия. Позднее в работах многочисленных авторов была доказана коррелятивная связь маточного и яичникового кровотока с фолликулогенезом и результативностью циклов ЭКО.
По-прежнему спорным вопросом остается оптимальное время выполнения допплерографии. Часть исследователей оценивают маточный кровоток перед началом стимуляции гонадотропинами, другие авторы - в день назначения хорионического гонадотропина, в день забора ооцитов или в день переноса эмбрионов в полость матки. Нерешенным остается вопрос возможности отсрочки или отказа от переноса эмбрионов, если показатели маточного кровотока показывают, что имплантация маловероятна. Считается, что если достигнут пограничный уровень показателей допплерографии, прогноз нерецептивности эндометрия матки имеет специфичность (96-100 %), положительный прогностический уровень (88-100 %), однако низкую чувствительность (13-35 %) и низкое негативное прогностическое значение (44-56 %).
Несмотря на то что спиральные артерии имеют большое значение в обеспечении маточной перфузии, лишь небольшое количество работ посвящено их изучению. Appelbaum (1998) описал 4 типа визуализации сосудов при допплерографии: 0 - сосуды визуализируются только в зоне миометрия; 1 - сосуды проникают за гиперэхогенный край эндометрия; 2 - сосуды достигают внутреннего гиперэхогенного края; 3 - сосуды достигают внутреннего края эндометрия. По данным авторов, отсутствие сосудов в эндометриальной зоне является абсолютным показателем негативного имплантационного прогноза, а у пациенток с проникновением сосудов к внутреннему краю эндометрия было получено наибольшее количество беременностей. Однако достоверной корреляции прогноза цикла ЭКО с параметрами кровотока и толщиной эндометрия авторам установить не удалось.
В последние годы появились работы, в которых показано, что способность ооцита к оплодотворению и дальнейшему росту и развитию эмбриона зависит не столько от размеров фолликула, сколько от его кровоснабжения . Так, в исследованиях A. Borini и соавт. было доказано, что количество полученных ооцитов достоверно коррелирует с индексом васкуляризации фолликулов (количество васкуляризированных фолликулов/общее количество фолликулов). Качество полученных эмбрионов коррелирует с PSV, в 70 % случаев при значении PSV более 10 см/с вероятно получение эмбрионов хорошего качества с высоким имплантационным потенциалом. J. Van Blerkom и соавт. в 2000 году доказали, что ооциты с дефектами цитоплазмы и эмбрионы с мультинуклеарными бластомерами происходят из фолликулов в состоянии гипоксии с плохим кровотоком. Гипоксия приводит к высокой частоте хромосомных аберраций. В этом исследовании был выявлен высокий индекс корреляции между фолликулярным кислородом, эндотелиальным сосудистым фактором роста и данными цветной допплерографии яичников в день назначения ХГ. Все эти показатели не зависели от размера фолликулов, то есть фолликулы одного размера могут иметь различный уровень насыщения кислородом. Авторы полагают, что фолликулы с интенсивным допплерографическим сигналом и перифолликулярным индексом резистентности менее 0,5 имеют высокий уровень кислорода.
Феномен наступления беременности.
Имплантационные механизмы.
Основные механизмы нарушения имплантации
Подчас очень трудно ответить на вопрос, почему у некоторых пар имеются повторяющиеся неудачные попытки ЭКО. За редким исключением, большинство практических врачей объясняют повторяющиеся или необъяснимые неудачные попытки ЭКО плохим качеством эмбрионов, однако качество эмбрионов зависит в основном от качества гамет: зрелости цитоплазмы, целостности веретена деления ооцита; морфологии, подвижности и состояния ДНК спермы.Качество ооцита - главный фактор, ограничивающий успех, так как именно в ооците происходят сложные трансформации, приводящие к появлению эмбриона. Половая клетка ооцит готовится к этому процессу в результате диалога с соматическими клетками гранулезы фолликула. В то же время извлечение ооцита путем пункции фолликула во время ЭКО значительно уменьшает этот диалог и изменяет развитие эмбриона in vitro (Antczac M., Van Blerkom J., 1997).
При беременности, наступившей естественным путем, очень большое значение имеет микроокружение эмбриона на разных стадиях его развития.
Фолликулярная жидкость Фолликулярная жидкость участвует в заключительных этапах созревания ооцитов в фолликулах и трубах. Перед овуляцией фолликулярная жидкость контролирует последние транскрипционные и посттранскрипционные изменения, которые позволят эмбриону осуществить синтез белков на протяжении первых этапов деления и сегментации. Абсолютная роль фолликулярной жидкости в настоящее время мало изучена. Многочисленные факторы роста и цитокины присутствуют в преовуляторном фолликуле.
Трубный и маточный секрет играет очень важную роль в развитии эмбриона. В течение 130-140 часов вплоть до самой имплантации эмбрион окружен этим секретом.
Трубная жидкость Микроокружение эмбриона в трубе не является анатомически гомогенным. Различные анатомические участки трубы, вероятнее всего, имеют свою собственную секрецию. В то же время присутствие эмбриона модулирует эту секрецию. Эмбрион подает специфические сигналы для того, чтобы регулировать свой путь в матку.
Биохимическое и иммунологическое равновесие, также как и анатомическое единство трубы нарушается инфекционной агрессией или воспалением
Микроокружение эмбриона в полости матки. К моменту входа эмбриона в полость матки объем секреции очень незначителен (несколько десятков микролитров), этот объем уменьшается параллельно увеличению секреции прогестерона. Клинические исследования с применением промывки полости матки в момент пункции яйцеклеток показывают, что выявление неадекватной секреции цитокинов, в частности интерлейкина-18 и фактора, ингибирующего лейкемию (ФИЛ), является признаком неадекватной рецептивности матки и позволяет предсказать потенциальное нарушение имплантации независимо от качества эмбрионов.
После оплодотворения трудно изменить развитие эмбриона на ранних стадиях. Но существуют также и другие, не эмбриональные причины неудач, на которые, к счастью, в большинстве случаев можно влиять. Эти факторы следующие:
1) возраст женщин и иногда мужчин;
2) проблемы рецептивности матки, зависящие от состояния слизистой;
3) техника переноса эмбрионов
Фолликулярный резерв яичников и качество ооцитов очень тесно взаимосвязаны между собой. Некоторые женщины рождаются с редуцированным запасом фолликулов, и снижение фертильности у них бывает очень ранним. К сожалению, на данном этапе этот процесс не поддается коррекции и предлагаемые различные протоколы стимуляции яичников (замена агонистов GhRH антагонистами, увеличение дозы ФСГ или чМГ) не улучшают прогноз.
В настоящее время уже уменьшилась спекуляция противопоставления ЭКО со стимуляцией суперовуляции получению яйцеклеток в естественном цикле. Сторонники применения ЭКО в естественном цикле полагают, что природа поступает лучше, чем мы (иногда это действительно так, но, к сожалению, чаще всего - если женщина молода).
Сторонникам спонтанного цикла необходимо напомнить, что 52 % ооцитов у молодых, нормально отвечающих женщин дисморфны (имеются нарушения морфологии).
Что в этом случае можно думать о женщинах более старшего возраста, с тотальной недостаточностью яичников с точки зрения увеличения цитогенетической аномалии. Полученные в этом случае эмбрионы в большинстве случаев анэуплоидны (70-80 % после 42 лет). В этих случаях не нужно спекулировать тем, что высокие дозы ФСГ увеличат пропорцию нормальных ооцитов, это просто необоснованные психологические и материальные затраты.
Эндометриальные маркеры имплантации эмбриона человека.
Рецептивность эндометрия
С развитием ВРТ многие пациентки, прежде считавшиеся безнадежно бесплодными, получили возможность зачать. Завершающим этапом всех процедур экстракорпорального оплодотворения ЭКО является имплантация бластоцисты после переноса женщине ее эмбриона. Сегодня хорошо известно, что успех имплантации зависит от временного соотношения между стадией развития эмбриона и периодом рецептивности эндометрия. Изучение особенностей функции и ультраструктуры эндометрия у человека в период имплантации занимало многих исследователей. Эндометрий подвергается постоянным изменениям в течение менструального цикла под воздействием эстрогенов и прогестерона в соответствии с изменениями их концентрации. Для успешного наступления имплантации развитие эндометрия и эмбриона должно быть синхронным. Можно предположить, что эмбрион, в свою очередь, также каким-то образом способствует созреванию эндометрия. Нарушения этого баланса могут изменить восприимчивость эндометрия и нарушить процесс имплантации.
Все внутриматочные повреждения нарушают рецептивность эндометрия. Все инфекционные и воспалительные заболевания, даже субклинические, обладают повреждающим эффектом. Инфекция является одной из главных причин как перинатальных осложнений, так и нарушений имплантации. Может ли в этом случае простая диагностическая гистероскопия с последующим антибактериальным или противовоспалительным лечением изменить прогноз неудачных попыток ЭКО и необъяснимого привычного невынашивания?
Кроме того, аденомиоз, субмукозная миома матки, многочисленные циклы индукции овуляции кломифена цитратом могут нарушить имплантацию. Учитывая, что имплантация эмбриона является следствием сложного диалога между трофобластом и эндометрием с вовлечением многочисленных провоспалительных цитокинов, не удивительно, что многочисленные неудачные попытки ЭКО и повторяющиеся самопроизвольные аборты связаны с иммунологическими нарушениями. В списке «виновников» находятся антифосфолипидные, антитиреоидные антитела и очень большое значение имеют активированные естественные киллеры - NK (natural killer). Необходимо, однако, отметить, что относительно роли антифосфолипидных антител имеются очень противоречивые публикации. Многочисленные работы подчеркивают роль Th1-цитокинов (синтезируемых активированными NK) и цитотоксических лимфоцитов у женщин с привычным невынашиванием и неудачными попытками ЭКО.
И, наконец, обнаружена корреляция между наличием антитиреоидных антител и цитотоксичных цитокинов при повторяющихся выкидышах. Лечение с применением кортикостероидов не всегда дает желаемые результаты и не лишено нежелательных вторичных эффектов. Применение гепарина и внутривенное введение иммуноглобулинов имеет различную эффективность.
Важной проблемой остается вопрос идентификации периода максимального соответствия развития эмбриона и восприимчивости эндометрия. Фаза имплантации наиболее критическая при проведении ЭКО. Развитие эмбриона зависит от внутриматочной среды, но в то же время сигналы от эмбриона модулируют дифференциацию эндометрия. Эта синхронизация называется окном имплантации.
Еще в 1945 году P. Vigano и соавт. провозгласили такой афоризм: «Бластоциста может виртуально имплантироваться в любом месте человеческого организма, кроме нерецептивного эндометрия». Перенос эмбрионов будет безуспешным, если отсутствует синхронизация между стадией развития эмбриона и эндометрия. Парадоксально, но приходится констатировать, что имплантация может наступить в любой ткани человеческого тела (при спонтанной или экспериментальной внематочной беременности) чаще всего без всякой предварительной подготовки этой ткани. В то же время эндометрий относится к числу тех редких тканей, где имплантация невозможна, за исключением окна имплантации. В этот период эндометрий максимально чувствителен к рецепции эмбриона. Предполагают, что у женщин этот период составляет 4 дня - с 20-го по 24-й день нормального менструального цикла и, следовательно, со дня сдачи лютеинизирующего гормона (ЛГ) + 7 до дня ЛГ + 11. В последние десятилетия доказано, что это окно имплантации практически всегда зависит от координированной экспрессии химиокинов, металлопротеаз, молекул адгезии, маточной и плацентарной экспрессии факторов роста, так же как и провоспалительных цитокинов, которые обеспечивают стадию аппозиции, затем адгезии, регулируют базальную инвазию плацентарного конуса, затем обеспечивают и регулируют как адгезию, так и инвазию клеток трофобласта в эндометрий.
Эта координированная экспрессия для некоторых медиаторов является полностью или частично гормональнозависимой от начала цикла до овуляции, когда секреция эстрогенов в дальнейшем сменяется смешанной эстрогено-прогестероновой. Под влиянием прогестерона эндометрий подвергается структурным и молекулярным модификациям, позволяющим эмбриону имплантироваться во время окна имплантации. Во время лютеиновой фазы на уровне различных структур происходит серия изменений - речь идет об эпителии желез и поверхности полости матки, клеток стромы сосудов и внеклеточного матрикса. К сожалению, оптический и даже электронный микроскоп не позволяет выявить никакой разницы в предимплантационный период у фертильных и бесплодных женщин. С 1950 года существует очень точная анатомо-морфологическая хронологическая система характеристики эндометрия, предложенная R.W. Noyes в 1975 году. Выявлено, что существует рассогласование между хронологической и гистологической датацией эндометрия. Эндометрий, исследуемый в лютеиновую фазу, может быть «в фазе» или «вне фазы». Существует расхождение более чем в 3 дня между фазой цикла и морфологическим строением. Взаимосвязь между этими морфологическими изменениями и рецептивностью эндометрия некоторыми исследователями отрицается. В то же время в работах других авторов доказана полезность этой датации (хронологии) и ее связь с бесплодием.
У человека окно имплантации очень мало изучено по ряду причин, среди которых доминируют технические и этические факторы. В действительности никакая модель in vitro не способна восстановить сложность динамического клеточного взаимодействия, активизирующего эпителиальные, стромальные иммунокомпетентные клетки, представленные в эндометрии на протяжении окна имплантации, необходимые для процесса аппозиции-адгезии и инвазии.
Наконец, чаще всего когда мы изучаем тонкое строение эмбриона, это приводит к его деструкции, и мы не можем изучить имплантацию именно этого эмбриона. Практика биопсии эндометрия у человека в периимплантационный период нежелательна.
Гормоны и рецептивность эндометрия
. Исследование эндометриальных пиноподий
Половые стероиды абсолютно необходимы для пролиферации и децидуализации эндометрия и подготовки его к имплантации эмбриона. Все основные процессы роста и созревания эндометрия регулируются представителями стероидных гормонов эстрадиолом (Е2) и прогестероном.
Прогестерон обеспечивает секреторную активность эндометрия, обеспечивая благоприятную среду для развития эмбриона и его имплантации. Секреторная трансформация эндометрия, вызванная прогестероном, сопровождается каскадом экспрессии генов, которые облегчают или, напротив, ограничивают имплантацию эмбриона. Яичниковые стероиды играют роль медиаторов в диалоге «эмбрион - матка» и модулируют экспрессию многочисленных факторов роста, цитокинов или молекул адгезии в материнско-плодовом пространстве. Среди этих гормонов некоторые, похоже, играют фундаментальную роль, например такие как прогестерон, Е2, а также хорионический гонадотропин человека (чХГ), ингибины, активин, релаксин, кальцитонин. Возможно, чХГ - одна из первых сложных молекул, синтезируемых эмбрионом. Он принимает участие на всех этапах диалога «эмбрион - матка». Однако ни один из этих гормонов или их рецепторов нельзя расценивать как маркер рецептивности эндометрия. Изолированное определение рецепторов к эстрогенам или прогестерону, проводимое у бесплодных женщин в момент пункции ооцитов, не позволяет абсолютно точно прогнозировать, будет имплантация или нет. Лептин, кодируемый геном ob, действует через гипоталамус на жировую ткань человеческого тела, играет значительную роль в процессе имплантации. Лептин и его рецепторы продуцируются эндометрием и плацентой. Этот гормон участвует в диалоге «матка - эмбрион» и модулирует инвазивные характеристики цитотрофобласта.
Исследование эндометриальных пиноподийКак показано многими исследователями, имплантация наступает только тогда, когда эндометрий, находящийся под определенным гормональным воздействием, вступает в фазу восприимчивости к имплантации бластоцисты.
Эта фаза достаточно короткая и должна совпадать с развитием эмбриона до стадии бластоцисты, определяя, таким образом, короткий интервал времени, когда возможна имплантация. Период, в течение которого эндометрий остается рецептивным для нидации эмбриона, получил название «окно имплантации». Предполагаемое окно имплантации человека теоретически совпадает с 20-22-м днем идеального 28-дневного менструального цикла.
Опыт работы в программе донорства яйцеклеток показал, что женщины, получающие заместительную гормональную терапию (ЗГТ) с последующим переносом эмбриона, имеют даже несколько выше шанс на успешную имплантацию, чем пациентки, проходящие стандартное ЭКО), вероятно, за счет влияния гормонов и лучшей координации времени переноса эмбриона, что возможно в циклах с ЗГТ. Важно учесть, что оптимальное время для переноса эмбриона в этих циклах ограничено и не превышает 3 дней. Так, для эмбриона 2-го дня благоприятный период находится между 3-м и 5-м днем приема прогестерона. Перенос эмбриона вне этого времени не приводит к его имплантации.
Эволюция морфологии клеток поверхностного эпителия следует определенной схеме, что дает возможность датировать биоптат секреторного эндометрия с точностью до 24-48 часов. Первые признаки формирования пиноподий представляют собой выраженное вздутие клеток, сочетающееся с исчезновением микроворсинок (МВ). Затем формируются гладкие и тонкие выпячивания мембраны, поднимающиеся со всей верхушки клетки (развивающиеся пиноподии). Вскоре после того как МВ полностью исчезают, выпячивания достигают своей максимальной величины и образуют складки или грибы (развитые пиноподии). Эта стадия длится менее 48 часов. Затем вздутие клеток уменьшается, и кончики МВ вновь появляются на поверхности мембран, которые становятся сморщенными, в то время как сама клетка начинает увеличиваться в размере (так называемый регресс пиноподий). Как выяснилось, эти изменения клеток возникают в вышеописанной последовательности во всех типах изученных циклов, а продолжительность существования развитых пиноподий обычно не превышает 2 дня. Однако конкретный день их формирования может варьировать у разных женщин. В естественных циклах развитие пиноподий наблюдается в дни пика ЛГ + 6-9 (19-22-й дни) у различных индивидов, в среднем на 20-й и 21-й дни цикла.
В циклах стимуляции яичников в программе ЭКО развитые пиноподии формировались на 18-22-й дни цикла (получение яйцеклеток на 14-й день) у различных женщин в зависимости от особенностей протоколов стимуляции. В большинстве случаев зрелые пиноподии наблюдались уже на 19-й день, что являлось достоверной акселерацией развития примерно на 1-2 дня по сравнению с естественными циклами.
В искусственных циклах день появления развитых пиноподий варьировал у женщин в промежутке до 3 дней (20-22-й дни цикла, или прогестерон 6-8). В данном случае 1-й день назначения прогестерона считался днем П1. Формирование пиноподий практически не исследовалось у пациенток с аденомиозом. Примечательно, что в единственном доступном исследовании у пациенток с диагнозом «эндометриоз» (средней и тяжелой степени) не было выявлено никаких отклонений в формировании пиноподий. Взаимосвязь между наличием пиноподий и исходом имплантаций была исследована в 17 искусственных циклах, предваряющих перенос донорских эмбрионов.
В исследование были включены только случаи с эмбрионами хорошего качества. В зависимости от количества пиноподии оценивались как изобилующие, умеренные и немногочисленные в зависимости от процента занимаемой ими поверхности эндометрия (> 50, 20-50 и < 20 соответственно). У всех 5 пациенток с изобилующими пиноподиями наступила беременность, 3 из 7 женщин с умеренным числом пиноподий также забеременели, в то время как ни у одной пациентки с малым количеством или с отсутствием пиноподий беременность не наступила .
Таким образом, можно подвести итоги - у женщин с нормальным менструальным циклом пиноподии появляются между 19-21-м днями менструального цикла, во время предполагаемого окна имплантации. Если говорить более точно, они открывают это окно, но, похоже, не присутствуют на всем его протяжении. Их появление абсолютно зависит от наличия прогестерона, а период полужизни длится менее 48 часов с вариациями у разных пациенток в зависимости от гормонального фона. Стимуляция яичников, похоже, ускоряет появление пиноподий, в то время как гормональная заместительная терапия тормозит их появление по отношению к нормальному циклу
Существует корреляция между числом пиноподий и имплантаций после переноса эмбрионов. Точная роль пиноподий пока что не доказана. Появление пиноподий, похоже, связано с феноменом аппозиции бластоцисты эпителию в просвете эндометрия. И, наконец, их появление связано с появлением молекул - участниц имплантации, например интегринов, или секрецией эпидермального фактора роста, который появляется в середине лютеиновой фазы.
Необходимо отметить, что в литературе имеются несколько противоречивые сведения относительно появления и продолжительности периода существования пиноподий. Как считают, несмотря на то, что пиноподии, очевидно, представляют собой определенную модификацию поверхности эндометрия, важную для имплантации, время их формирования на клетках поверхностного эпителия отчетливо выходит за пределы предполагаемого окна имплантации. A. Acosta и соавт. в своем обширном исследовании также показали несколько отличающиеся результаты: истинные пиноподии появляются небольшими группами с 20-го дня цикла и остаются до конца секреторной фазы.
Эти разногласия можно объяснить следующим образом. В позднюю секреторную фазу клетки поверхностного эпителия эндометрия подготавливаются к отторжению во время менструации. Это проявляется в виде увеличения (набухания) клеток и может быть ошибочно принято за «долгоживущие пиноподии». Эти клетки неодинаковы по размерам и кажутся потрескавшимися или сморщенными в результате апоптоза и некротических изменений, в чем заключается их отличие от истинных пиноподий. В исследованиях других авторов всегда наблюдалось отсутствие истинных пиноподий уже после пика ЛГ + 10 дней, что согласуется с другими данными.
В настоящее время единственным достоверным методом изучения пиноподий является электронная микроскопия. Пиноподии могут быть визуализированы также под световым микроскопом как выпуклые апикальные выпячивания клеток, однако лимитирующими факторами являются низкое разрешение световой микроскопии и невозможность исследования больших участков тканевого среза.
Неясной остается роль пиноподий в процессе имплантации. В отличие от грызунов в эндометрии человека пиноподии не участвуют в абсорбции жидкости из полости матки. Исходя именно из этого факта, C. Murphy предложил именовать плазматические выпячивания не пиноподиями, а ютеродомами (uterodomes), что, по его мнению, наиболее четко отражает происхождение и не затрагивает описание функциональных качеств клеточных образований.
Тем не менее связь пиноподий (сегодня это название является общепринятым) с факторами роста и другими биологически активными веществами предполагает их возможное непосредственное участие в механизме имплантации. Со своей апикальной поверхности они, например, могут стимулировать клеточную пролиферацию и инвазию эмбриона и способствовать децидуализации эндометрия.
Вариабельность появления пиноподий от одного цикла к другому, необходимость биопсии во время окна имплантации, а также необходимость электронной микроскопии ограничивают широкое клиническое применение этого маркера. Дальнейшее исследование факторов имплантации позволяет углубить понимание процесса имплантации и идентифицировать маркеры периода имплантационного окна. В идеале они должны определяться неинвазивным методом, что позволило бы проводить перенос эмбриона в том же цикле. Сегодня клиническое исследование эндометрия на наличие пиноподий является эффективным, но инвазивным методом оценки эндометриального статуса. Обычно оно производится в естественном цикле после нескольких неудачных циклов ЭКО. Проводить перенос в этом же цикле не представляется возможным, а состояние эндометрия в стимулированном цикле все же несколько отличается от такового в естественном цикле.
Эмбрион является активным участником процесса имплантации. Наличие бластоцисты в стадии позиционирования предохраняет эндометрий от апоптоза. В работе A. Galan (2000) показано, что даже эмбрионы, не достигшие стадии бластоцисты, снижают количество апоптотических клеток в культуре эндометриальных эпителиальных клеток. Однако далее, на стадии адгезии, бластоциста индуцирует паракринную апоптотическую реакцию. Вероятнее всего, система запуска апоптоза Fas/Fas-L задействована в преодолении барьера для имплантации бластоцисты.
Наряду с вышеизложенными механизмами в имплантации эмбриона задействованы иммунологические процессы. В 1953 году Питер Брайн Медавар впервые выдвинул гипотезу, согласно которой плод рассматривается как наполовину чужеродный аллогенный трансплантат. В последующем были проведены многочисленные научные исследования в области иммунологии репродукции, однако удалось выяснить лишь некоторые механизмы иммунологической толерантности материнского организма к плоду.
Механизмами, обеспечивающими процесс выживания эмбриона и плода, являются:
- селективная экспрессия антигенов, являющихся критическими по аллореактивности;
- наличие некоторых цитокинов в маточно-плодовом пространстве;
- локальная продукция специфических иммуносупрессивных агентов (Шмагель К.В., 2003).
Взаимодействие между матерью и эмбрионом развивается в двух несколько различных направлениях. С одной стороны, фетоплацентарные ткани нуждаются в надежной антиинфекционной защите, с другой стороны - необходима толерантность к плацентарным аллоантигенам. На стадии имплантации и ранних стадиях эмбриогенеза толерантность обеспечивается преимущественно неспецифическими механизмами, такими как гормональная иммуносупрессия (хорионический гонадотропин, прогестерон), некоторыми специфическими антигенными свойствами трофобласта.
Одним из первых изменений в периферическом иммунном ответе является увеличение количества лейкоцитов. Наиболее изученным являются изменения в состоянии Т-лимфоцитов. В популяции Т-лимфоцитов выделяют Т-хелперы (Тх) и Т-цитотоксины/супрессоры (Тс). Тх помогают другим иммунным клеткам, продуцируя цитокины, а Тс могут непосредственно элиминировать чужеродные и инфицированные клетки. Количество Тх и Тс может либо изменяться, либо не изменяться на протяжении беременности. Тх по типу цитокинов, которые они продуцируют, разделяют на 2 типа: первый (Тх-1) и второй (Тх-2). Тх-1 - провоспалительные цитокины продуцируют гамма-интерферон, IL-2, фактор некроза опухоли, которые стимулируют клеточные реакции. Тх-2 - противовоспалительные цитокины продуцируют IL-4, IL-5, IL-9, IL-10, IL-13, которые принимают участие в гуморальном иммунном ответе.
В 1993 году T.G. Wegmann и соавт. впервые предложили концепцию беременности как Тх-2 феномена. Переключение продукции цитокинов с типа Тх-1 на Тх-2 происходит под влиянием прогестерона через индукцию прогестерониндуцированного блокирующего фактора в лимфоцитах. Другим механизмом влияния может быть «вмешательство» трофобласта в продукцию цитокинов. Так, было показано, что in vitro плацентарные и трофобластические клетки продуцируют факторы, тормозящие цитотоксическую активность Т-лимфоцитов. Более того, трофобластические клетки продуцируют цитокины преимущественно 2-го типа, что также определяет материнский ответ.
Таким образом, успешность беременности поддерживается в основном типом реакции Тх-2. Цитокины 1-го типа могут прямо или опосредованно разрушать эмбрион путем активации цитотоксичности. Так, TNF-α может вызвать некроз имплантированного эмбриона, гамма-интерферон ингибирует секрецию CSF-1, который способствует росту и дифференцировке бластоцисты. Среди цитокинов типа Тх-2, наверное, наиболее важным является IL-10. Этот цитокин продуцируется в большом количестве в децидуальном слое на материнско-фетальной границе. Инъекции IL-10 клону мышей, склонных к самопроизвольным абортам, обеспечивали сохранение беременности, и, наоборот, введение им анти-IL-10-антител увеличивало количество самопроизвольных абортов.
Несмотря на большое значение натуральных киллеров в механизмах сохранения беременности, в литературе опубликовано очень мало данных относительно периферических NK у беременных. Количество NK, а также продукция ими гамма-интерферона значительно уменьшается у беременных в сравнении с небеременными. Эти изменения количества и активности NK также связаны с переключением от клеточного к гуморальному типу иммунного ответа.
У беременных NK являются эмбриотоксическими. Так, A. Beer и соавт. (1996) показали, что если у женщин, проходящих лечение методом ЭКО, процентное соотношение превышало 18 %, рождение живых детей не наблюдалось. Более того, у пациенток с самопроизвольными абортами Т-лимфоциты и NK-клетки проявляли эмбриотоксичность in vitro.
Во время инвазии эмбриона трофобласт тесно контактирует с различными материнскими клетками, такими как железистые, стромальные, эндотелиальные клетки, и особенно материнские лейкоциты. Лейкоциты составляют около 10 % клеток стромы в фазе пролиферации, 20 % - в середине секреторной фазы (предымплантационный период) и возрастают до 30 % при наступлении беременности.
Популяция лейкоцитов состоит из Т-клеток, макрофагов и больших гранулезных лейкоцитов - LGL (large granulated lymphocytes). Часть Т-клеток составляет 45 % в фазе пролиферации и уменьшается в секреторной фазе, абсолютное их количество остается неизменным на протяжении менструального цикла. Количество макрофагов также остается постоянным, увеличиваясь только в стадии десквамации.
LGL, или эндометриальные NK, функционально и фенотипически принадлежат к естественным киллерам, но в отличие от NK периферической крови они экспрессируют CD56, но не экспрессируют CD16 и CD57. Они редко встречаются в эндометрии в фазу пролиферации, однако в лютеиновую фазу и в фазу ранней гестации их количество быстро возрастает и составляет более 80 % всех лейкоцитов. NK образуются в костном мозге. После дифференцировки они попадают в периферическую циркуляцию на очень ранней стадии созревания. Их физиологическая роль заключается в контроле интенсивности инвазии трофобласта и предупреждении возникновения локальной инфекции. Материнские Т-клетки теоретически не могут ни распознать, ни уничтожить фетальные клетки, которые не имеют антигенов классических молекул МНС (major histocompatibility complex - главного комплекса гистосовместимости) класса 1 и 2. Децидуальные Т-клетки также не могут in vitro разрушить клетки трофобласта первого триместра, но если на протяжении короткого времени их выдержать с IL-2, они активируются и могут специфически распознавать и убивать клетки, которые не имеют или имеют недостаточное количество антигенов класса МНС (King A., 1999). Возникает вопрос, каким образом фетальные клетки избегают разрушения LGL in vivo, ведь в эндометрии определяется большое количество IL-2. Пять независимых групп экспертов пришли к выводу, что защиту от цитолиза, обусловленного LGL, выполняют молекулы HLA-G и HLA-1b. Были обнаружены рецепторы на LGL, которые могут посылать тормозящие сигналы после взаимодействия с HLA-G и, вероятно, HLA-1b-антигенами. Однако, несмотря на наличие таких тормозящих сигналов, в работах ряда авторов было доказано, что повышенное количество периферических NK в крови и повышенная инфильтрация эндометрия NK вызывает перенапряжение и срыв механизмов блокировки, что приводит к нарушению имплантации в программах ЭКО и таким осложнениям беременности, как преэклампсия и самоаборты. Другой важный механизм защиты эмбриона связан с тем, что во время имплантации запускаются провоспалительные процессы, местные лейкоциты активируются, под влиянием хемокинов появляется большое количество фагоцитирующих клеток. Львиную долю этих клеток составляют полиморфноядерные лейкоциты (нейтрофилы и эозинофилы), которые обладают очень коротким периодом жизни и погибают в течение 1-3 дней. Через несколько дней заканчивается провоспалительная фаза беременности, под действием прогестерона и инвазии бластоцисты происходит сдвиг баланса цитокинов с Tx-1 к Tx-2-типу.
Окно имплантации и окно переноса
Необходимо различать окно имплантации и окно переноса. Действительно, большинство программ ЭКО предполагают перенос эмбрионов в полость матки на стадии 4-8 клеток (2-3-й день после оплодотворения). Этот промежуток времени называется окном переноса и предшествует окну имплантации на 2-4 дня. В настоящее время большинство репродуктологов стремится пролонгировать культивирование эмбрионов in vitro до стадии бластоцисты.
Основная цель пролонгированного культивирования - синхронизировать окно переноса и окно имплантации, убедиться in vitro, что произошла активация генома эмбриона (стадия 8 клеток) и что предымплантационное развитие эмбриона удовлетворительное. Все это должно увеличить процент имплантаций. Противники пролонгированного культивирования приводят аргументы о необходимости перенести эмбрион как можно быстрее в его физиологическую среду, так как условия in vitro не абсолютно идентичны условиям in vivo. И, кроме того, созревания эндометрия при стимуляции яичников ускорено. И, наконец, результаты пролонгированного культивирования значительно варьируют от одной команды к другой.
Описание процесса имплантацииИмплантация состоит из двух феноменов: аппозиция-адгезия, общая для всех млекопитающих, и инвазия, которую находят у rongeurs и приматов (следовательно, у человека). В этих двух группах начало имплантации имеет фиксированную точку отсчета, после «вылупливания» бластоцисты из блестящей оболочки или же после хетчинга. Адгезия трофобластического эпителия и эндометрия - настоящий биологический парадокс. На уровне места имплантации эти два эпителия разного генетического происхождения (эпителий бластоцисты с одной стороны и неадгезивная поверхность апикальной части клеток эпителия с другой стороны) сливаются. Доказано раннее влияние фетального онкофибронектина, выявляемого на наружной поверхности клеток трофобласта, и интегринов, расположенных по краю апикально-латеральных клеток эпителия матки. На участке концептуса, где происходит первый контакт между трофобластом и эпителием просвета, в дальнейшем формируются ворсины хориона с последующим формированием плаценты.
Адгезия бластоцисты к эпителию просвета
Неадгезивная природа эпителия матки обусловлена наличием слоя гликокаликса, покрывающего поверхность клеток эпителия. Гликокаликс - разновидность муцина MUC-1 - экспрессирован на поверхности клеток эпителия человека и мышей. У человека его экспрессия максимальна в период имплантации, в то же время у мышей она минимальна в этот момент. У женщин экспрессия MUC-1 на уровне эпителия матки прогестеронозависима и возрастает к концу фазы пролиферации, чтобы стать максимальной во время окна имплантации (Hey N.A., 1994).
В последних работах с использованием клеточной культуры in vitro при культивировании клеток эпителия и человеческого эмбриона доказано, что во время фазы аппозиции наличие эмбриона увеличивает экспрессию MUC-1 на уровне клеток эпителия. Но после адгезии бластоцисты к клеткам эпителия наступает паракринное ингибирование синтеза MUC-1 в месте имплантации. Можно сделать вывод, что MUC-1 - антиадгезивная молекула, которая, вероятнее всего, локально при наличии бластоцисты становится участником фазы адгезии.
Инвазия трофобласта
В зависимости от степени проникновения трофобласта в эндометрий различают гистологический тип плаценты. У человека и позвоночных эта пенетрация максимальна с эрозированием сосудистого эндотелия. Следовательно, речь идет о гемохориальном типе плацентации. У приматов инвазия происходит путем интрузии: синцитиотрофобласт проникает между клетками эпителия матки, прежде чем их фагоцитировать. Связывание клеток трофобласта с составляющими базальной мембраны и внеклеточного матрикса осуществляется посредством интегринов. Распространение трофобласта в строму матки сопровождается лизисом базальной мембраны путем активации протеаз и металлопротеаз. Этот процесс строго контролируется и ограничивается местом имплантации (в отличие от опухолевого процесса) благодаря равновесию между секрецией металлопротеаз и их специфических ингибиторов - тканевых ингибиторов металлопротеаз под влиянием цитокинов и факторов роста (фактор некроза опухоли, ФИЛ, эпидермальный фактор роста).
Перенос эмбрионов
Наряду с проблемами рецептивности эндометрия техника переноса при хорошем качестве эмбрионов, как нам кажется, является определяющим моментом. Лучше выполнять его под контролем УЗИ, чтобы избежать травматизации эндометрия и кровянистых выделений. Сокращения матки и дискомфорт после переноса также являются векторами неудачной имплантации.
Хорошим прогностическим резервом, при условии что все остальные факторы фертильности в норме, является пролонгирование культивирования эмбрионов. И здесь необходимо отметить, что блокирование развития эмбрионов на 3-й или 4-й день культивирования во время активации генома эмбриона чаще всего зависит от особенностей спермы, а не яйцеклетки, особенно если на 3-й день эмбрион правильной формы и не фрагментирован. В заключение необходимо напомнить, что правильно собранный анамнез, адекватное обследование помогают принять правильное терапевтическое решение. Этот этап также помогает нам достичь максимальной эффективности лечения, при условии что эмбриологи также будут проводить селекцию эмбрионов. В случае неудачных попыток необходимо производить повторный анализ истории супружеской пары с учетом выявленных возможных причин неудач. Многие ли клиницисты и эмбриологи выполняют это? В то же время большинство пар с неудачными попытками ЭКО нуждаются в более индивидуализированном, адаптированном лечении. А правильно изложенная информация позволяет супружеским парам раньше обратиться к другим программам (донация яйцеклеток и эмбрионов, адаптация).
Проблема невынашивания беременности является актуальной в современном акушерстве. Частота этой патологии в популяции колеблется от 10% до 20-25%, а в группе беременных после экстракорпорального оплодотворения и переноса эмбрионов (ЭКО и ПЭ) достигает 30%. Поскольку одной из основных причин невынашивания в 1 триместре беременности после ЭКО является недостаточность желтого тела, обусловленная длительной десенситизацией гипофиза, пониженной выработкой прогестерона зернистыми клетками, а также аспирацией части их во время пункции фолликулов, целесообразность назначения препаратов прогестерона после переноса эмбрионов не вызывает сомнения.
Для успешной имплантации эмбриона необходимо согласование во времени готовности эндометрия к имплантации с развитием эмбриона (так называемое «имплантационное окно»). Принципиальную роль в подготовке слизистой оболочки матки к имплантации играет прогестерон. Обнаружено, что в циклах индуцируемой овуляции нередко происходит асинхронное по отношению к овуляции созревание эндометриальных желез и стромы. В циклах стимуляции в рамках программы ЭКО и ПЭ Bourgain и соавторы обнаружили своевременное созревание эндометрия только у 50% пациенток.
Появляется все большее количество данных в пользу того, что иммуномодулирующее действие гормонов имеет важное значение для поддержания нормальной функции эндометрия. Результаты некоторых последних исследований с очевидностью свидетельствуют об иммунологической роли прогестерона и дидрогестерона в поддержании беременности, осуществляемой ими посредством стимулирования продукции блокирующего фактора, индуцируемого прогестероном (БФИП).
Общепризнано, что для нормального исхода беременности иммунная система женщины должна распознать ее. При нормально протекающей беременности в лимфоцитах периферической крови присутствуют рецепторы прогестерона, причем доля клеток, содержащих такие рецепторы, увеличивается по мере увеличения срока гестации. В случае угрозы прерывания беременности доля клеток, содержащих рецепторы прогестерона, существенно ниже, чем у здоровых женщин, находящихся на том же сроке беременности. Ряд ученых полагает, что увеличение числа рецепторов прогестерона при беременности может быть вызвано присутствием эмбриона, который выступает в роли хорионического аллоантигенного (чужеродного) стимулятора.Профессору Сикерес-Барто удалось показать, что дидрогестерон, подобно прогестерону, индуцирует продукцию БФИП в лимфоцитах беременных женщин, при этом эффект пропорционален принятой дозе лекарства. При этом БФИП оказывает влияние на баланс цитокинов, в результате чего продукция цитокинов Th1 снижается. Это, в свою очередь, ведет к снижению активности естественных киллерных клеток (ЕКК) и обеспечивает нормальный исход беременности. При блокаде рецепторов прогестерона БФИП не вырабатывается и, как следствие, увеличивается концентрация цитокинов Th1 (Т-хелперов). Это способствует повышению активности ЕКК и абортам. С другой стороны, при наличии свободных рецепторов прогестерона и нормальной выработке БФИП нейтрализация эффекта БФИП антителами также ведет к преобладанию цитокинов Th1, усилению клеточного иммунного ответа и повышению активности ЕКК, что также способствует абортам.
Исходя из вышесказанного поддержка второй фазы препаратами прогестерона (масляный раствор прогестерона, Дофастон и т.д.), по мнению многих авторов, должна быть рутинной процедурой, поскольку увеличивает процент имплантации при проведении программы ЭКО и ПЭ.
Предполагается, что лекарственные средства, применяемые для поддержания второй фазы, должны характеризоваться высокой гестагенной и низкой андрогенной активностью.
Прогестерон в кристаллической форме не абсорбируется при пероральном введении. Его применение требует, ввиду короткого периода полураспада, введения ежедневно масляных внутримышечных инъекций. Однако в связи с тем, что длительное применение инъекций масляного раствора прогестерона сопряжено с дискомфортом и риском развития известных осложнений в виде образования олеом и постинъекционных абсцессов, на повестку дня встал вопрос о возможности применения в программах вспомогательной репродукции неинъекционых аналогов прогестерона.
При применении микронизированного прогестерона для того, чтобы вызвать достаточные секреторные изменения в эндометрии, суточная доза препарата должна составлять в среднем 600 мг в сутки. В таком случае в кишечнике и печени образуются значительные количества промежуточных метаболитов, которые могут оказывать побочное действие в виде седации. Более предпочтительным путем применения микронизированного прогестерона в стимулируемых циклах является интравагинальное его введение. Данная форма введения не всегда удобна и приемлема для пациенток.
Другой группой прогестагенов, которые могут быть использованы для поддержки лютеиновой фазы у пациенток, подвергшихся лечению бесплодия методом ЭКО, являются ретропрогестероны. В наиболее часто применяемом ретропрогестероне - дидрогестероне (Дюфастон) метильная групппа в позиции 10 расположена в позиции a (а в прогестероне - в позиции b), водород при углероде 9 находится в позиции b, кроме того, между углеводами 6 и 7 имеет место двойная связь. Изменение конфигурации молекулы приводит к тому, что Дюфастон легко абсорбируется при пероральном введении. Дидрогестерон в дозе 20-30 мг вызывает в эндометрии полноценную фазу секреции. Исследования, проведенные на животных, подтверждают высокую способность дидрогестерона поддерживать беременность.
Таким образом, Дюфастон является сильнодействующим гестагеном, эффективным при приеме внутрь, который по своей молекулярной структуре и фармакологическому действию близок к эндогенному прогестерону и вследствие этого обладает высокой афинностью (сродством) к рецепторам прогестерона.
В отличие от многих прогестагенов он не является производным тестостерона, его структура отличается от структуры большинства синтетических прогестагенов вследствие чего не вызывает ни одного из побочных эффектов, характерных для большинства прогестагенов. Преимуществами химической структуры дидрогестерона является более высокая биодоступность препарата после перорального применения и отсутствие метаболитов с андрогенной или эстрогенной активностью.В отличие от других синтетических прогестагенов Дюфастон:
- не вызывает феминизации плода мужского пола и не оказывает побочного действия на функции печени и свертываемость крови;
- не вызывает таких проявлений, как угревые высыпания, огрубение голоса, гирсутизм и маскулинизации половых органов плода женского пола;
- также не вызывает метаболических эффектов, например, изменения липидного спектра крови и концентрации глюкозы;
- не влияет на активность гипофизарно-яичниковой системы и не вызывает атрофии надпочечников.
Дюфастон хорошо всасывается после введения внутрь. Основным метаболитом является 20a-дигидроксидидрогестерон, который также обладает прогестагеновой активностью.
Высокая безопасность Дюфастона, подтвержденная многолетним опытом его применения, особенно отсутствие тератогенного действия, позволяет уверенно применять препарат в качестве гормональной поддержки в период после переноса эмбрионов в рамках программы ЭКО и ПЭ. Кроме того, по сравнению с микронизированным прогестероном дидрогестерон не обладает седативным действием.
Дюфастон является оптическим изомером прогестерона и благодаря изменению конфигурации молекулы легко абсорбируется при пероральном введении. Его применение не сопровождается ни андрогенным, ни антиандрогенным эффектом на плод, а также на процесс дифференцировки пола. Метаболизм данного препарата не приводит к отрицательному воздействию на желудочно-кишечный тракт, поэтому обоснована возможность более длительного его применения при беременности (до 20 нед).
Назначается Дюфастон со дня трансвагинальной пункции яичников или со дня переноса эмбрионов в дозе 30-60 мг в сутки до 12 недель беременности. По показаниям (при угрозе прерывания беременности) возможно применение Дюфастона до 20 недель беременности.
В случае отсутствия риска развития синдрома гиперстимуляции яичников возможно параллельное применение препаратов хорионического гонадотропина по следующей схеме: в день переноса эмбрионов 5 тыс. ед., а далее по 1,5 тыс. ед. на 3-й, 6-й и 10-й дни после переноса эмбрионов.
Таким образом, препарат Дюфастон обеспечивает адекватную подготовку эндометрия для успешной имплантации эмбриона и гормональную поддержку беременности в I триместре при снижении или отсутствии его эндогенного синтеза.
Клинический пример
Пациентка С., 26 лет, обратилась в клинику ВРТ «Дети из пробирки» в 2005 г. с диагнозом: бесплодие II, сочетанное (трубно-перитонеальный фактор, мужской фактор бесплодия). Привычное невынашивание.
В анамнезе 5 попыток ЭКО: при 1-й попытке беременность не наступила, 2 протокола закончились неразвивающейся беременностью по типу гибели эмбриона на сроке 8 недель и 1 - правосторонней трубной беременностью. Проводилось прямое кариотипирование клеток ворсинчатого хориона неразвивающейся беременности, в обоих случаях установлен кариотип абортусов - 46ХХ.
В 2007 г. проведена диагностическая лапароскопия, при которой выявлен спаечный процесс в малом тазу, окклюзия левой маточной трубы. Произведена левосторонняя тубэктомия, адгезиолизис. При проведении повторного гистологического исследования биоптата эндометрия в 2007 г. выявлена простая железисто-кистозная гиперплазия эндометрия. Проведена десенситизация гипофиза агонистами гонадолиберинов в течение 2 месяцев. При контрольной биопсии на 7 день цикла - пролиферативный эндометрий.
В клинике проведено полное обследование супружеской пары. При проведении обследования диагностирован антифосфолипидный синдром на основании следующих диагностических критериев: повышение титра антител к бета-2 гликопротеину - 1 до 35,5 u/ml (N < 20 u/ml), антиспермальных антител до 24,5 u/ml (N < 20 u/ml) волчаночного антикоагулянта до 56 u/ml (N < 35 u/ml), антител к кардиолипину до 11,5 u/ml (N < 10 u/ml). Исследование проведено дважды с интервалом в 12 недель.
В связи с выявленным АФС, учитывая привычное невынашивание, пациенке С. рекомендовано исследование полиморфизма генов гемостаза. Анализ полиморфизмов генов свертывающей системы выявил в генотипе женщины наличие гетерозиготных вариантов в генах фибриногена, метилентетрагидрофолатредуктазы, метионин-синтазы редуктазы, метионин-синтазы, интегрина альфа-2 и Р-селектин лиганда гликопротеина. Носительство данных полиморфизмов при воздействии провоцирующих факторов (беременность, гормональная терапия, курение, оперативное вмешательство, инфекционное заболевание, АФС) повышает уровень фибриногена и гомоцистеина, умеренно повышает скорость адгезии тромбоцитов в плазме крови, что увеличивает риск рецидивирующих тромбозов, дефектов нервной трубки плода, невынашивания беременности, преждевременной отслойки плаценты.При проведении ультразвукового исследования органов малого таза на 7-й день ментруального цикла было обнаружено повышение эхогенности, неровный контур и неоднородная структура эндометрия, расширение вен миометрия до 4,5 мм. При допплерометрии было выявлено увеличение систоло-диастолического коэффициента в правой и левой маточных артериях.
Биопсия эндометрия проведена на 7-й день менструального цикла с помощью шприца-аспиратора Ipas MVA Plus. Биоптат отправлен на гистологическое и бактериологическое исследование. Гистологическая картина соответствовала хроническому эндометриту: в препарате - воспалительные инфильтраты, состоящие преимущественно из лимфоидных элементов, расположенные вокруг желез и кровеносных сосудов. Очаговые инфильтраты имели вид «лимфоидных фолликулов» во всех отделах функционального слоя, очаговый фиброз стромы. По результатам бактериологического посева биоптата эндометрия обнаружен рост бактероидов 103. В мазках на флору - лейкоцитоз до 30 лейкоцитов в поле зрения, обильная мелкобациллярная флора, незавершенный фагоцитоз, единичные споры грибов.
Супруг пациентки также обследован. При исследовании спермограммы выявлено: снижение общего количества сперматозоидов в эякуляте до 8,2 млн/мл (N > 20 млн/мл), снижение количества подвижных сперматозоидов до 13% (N>50%), количество морфологически нормальных сперматозоидов 18% (N >30%). Сперматозоиды с патологической морфологией 82%, из них 61% - с патологией головки, 2% - с патологией шейки, 1% - с патологией хвоста и 18% сперматозоидов с патологией смешанного типа. В крови пациента выявлено повышение уровня антиспермальных антител до 24,5 u/ml (N < 20 u/ml). Пациент осмотрен урологом, для преодоления бесплодия рекомендовано ЭКО + ИКСИ.
На основании проведенного обследования супружеской пары установлен диагноз: бесплодие II, сочетанное (трубно-перитонеальный фактор, астенотератозооспермия). Синдром потери беременности. Антифосфолипидный синдром. Генетически-обусловленная тромбофилия. Хронический эндометрит, обострение.
В качестве прегравидарной подготовки пациентке С. проведено 2 курса антибактериальной системной терапии с учетом чувствительности к антибиотикам выявленного возбудителя, санация влагалища. Противомикробная терапия сочеталась с физиотерапевтическим лечением (10 сеансов гелий-неонового лазера по стандартной методике). В связи с выявленными тромбофилическими мутациями рекомендован прием фолиевой кислоты (5 мг/сутки).
Пациентке С. назначена схема стимуляции суперовуляции по короткому протоколу ЭКО с 3-го дня менструального цикла. Стимуляция проводилась рекомбинантными гонадотропинами в суммарной дозе 2100 ЕД, десенситизация гипофиза проводилась агонистами гонадотропинов ежедневно. В качестве триггера овуляции использовался хорионический гонадотропин 10 000 ЕД.
Трансвагинальная пункция проведена на 12-й день менструального цикла. Пунктировано 15 фолликулов, получено 15 ооцитов М II. Характеристика спермы супруга на день пункции: концентрация 19 млнмл, прогрессивно подвижных а=0%, в=0%, с=12%, морфологически нормальных 6%. ИКСИ проведено на 15 ооцитах. На 1-й день оплодотворилось 13 ооцитов, которые продолжили нормальное развитие на 2 и 3 дни. На 17-й день цикла произведен трансфер 2 эмбрионов в полость матки на стадии бластоцисты 5АА и 5АВ. Криоконсервированы 4 бластоцисты 4АВ, 5АВ, 4ВС, 5ВС. Толщина эндометрия на день переноса - 11 мм.
Поддержка посттрансферного периода проводилась микронизированным прогестероном 600 мг/сутки интравагинально. На 7 день переноса уровень эстрадиола в перефирической крови составил 784 нг/л, прогестерона - 110 мкг/л. В гемостазиограмме произошел сдвиг показателей в сторону гиперкоагуляции: фибриноген 553 мг/дл (норма до 400 мг/дл), Хагеман-зависимый фибринолиз 13 мин (норма до 12 мин), РФМК 11 г/лх102 (норма < 5,5 г/лх102), в связи с чем пациентке назначен дипиридамол 25 мгх 3 р/сутки. При контрольной гемостазиограмме через 7 дней уровень фибриногена снизился до 407 мг/дл, Хагеман-зависимый фибринолиз и уровень РФМК остались без изменения. Уровень в-ХГЧ на 14-й день цикла - 100 мМЕ/мл. При исследовании в-ХГЧ на 21-й день после переноса эмбрионов - менее 11,2 мМЕ/мл, при проведении ультразвукового исследования выявлен гравидарный эндометрий 10 мм, плодного яйца в полости матки не было обнаружено. Гормональная поддержка отменена, беременность не наступила.
С целью подготовки к криопротоколу пациентке С. в периконцепционный период была назначена фолиевая кислота 5мг/сутки ежедневно, в пищевой рацион рекомендовано ввести продукты, богатые витаминами С, Р, группы В-В1, В6, В12. Через 3 месяца пациентке назначен новый протокол ВРТ.
Стимуляция пролиферации эндометрия начата со 2-го дня цикла эстрадиол валератом в начальной дозе 4 мг/сутки с постепенным увеличением дозы к 11-му дню менструального цикла до 12 мг/сутки. С 15-го дня цикла начато введение масляного раствора прогестерона 2,5% - 6 мл/сутки. Учитывая особенности свертывающей системы и АФС, пациентке на фоне гормональной терапии назначен НМГ (эноксапарин натрий, 40 мг 1 раз в сутки, подкожно) под контролем показателей гемостазиограммы. На 19 день менструального цикла произведен трансфер 2 бластоцист (5АВ и 4АВ) в полость матки. Толщина эндометрия на день переноса составила 12 мм. Поддержка посттрансферного периода продолжена эстрадиол валератом 12 мг/сутки и масляным раствором прогестерона 2,5 5-6,0 в/м, НМГ (эноксапарин натрий, 40 мг/сутки, подкожно). При контроле гемостазиограммы выявлена изокоагуляция, показатели гемостаза не выходили из референсных значений. Уровень эстрадиола на 7-й день после переноса эмбрионов составил 520 нг/л, прогестерона 200 мкг/л. На 14-й день уровень в-ХГЧ составил 720 мМЕ/мл. На 21-й день после переноса при УЗ-исследовании в полости матки выявлено 1 плодное яйцо его средним внутренним диаметром 6 мм.
Беременность пациентки в первом триместре протекала без особенностей. Показатели пренатального скринига - в пределах нормальных популяционных значений. Морфологический ультразвук в 22 недели не выявил отклонений в развитии плода. Введение НМГ в дозе 40 мг/сутки и 5 мг фолиевой кислоты продолжали на протяжении всего периода беременности под контролем показателей гемостазиограммы каждые 7-10 дней. С 25-й недели беременности у пациентки развился гестоз. На 36-й неделе выявлена симметричная форма задержки внутриутробного развития плода, нарушение маточно-плацентарного кровотока, прогрессирование гестоза, в связи с чем пациентка была госпитализирована в отделение патологии беременности. Экстренное корпоральное кесарево сечение проведено на 36-37 неделе беременности из-за преждевременной отслойки нормально расположенной плаценты. Родилась живая недоношенная девочка весом 2500 г, рост 46 см, оценка по шкале АПГАР - 6-8 баллов.
Многочисленные неудачные попытки ЭКО у пациентки С. по-видимому были обусловлены хроническим эндометритом и патологией свертывающей системы. Хронический эндометрит является важным фактором в развитии патологии репродуктивной функции и требует обязательной верификации и лечения у женщин с бесплодием, неудачными попытками ЭКО, привычным невынашиванием. Эпидемиологические исследования свидетельствуют о том, что ХЭ выявляется примерно у 10% женщин репродуктивного возраста, однако у пациенток с нарушениями генеративной функции его распространенность увеличивается до 23-57% .
Диагностические сложности возникают при верификации ХЭ. Эталонным методом диагностики является патоморфологическое исследование. Причем, оптимальным сроком получения диагностического материала является средняя пролиферативная фаза. Морфологическое исследование материала, полученного в секреторной фазе цикла, недостаточно информативно. Поэтому исследование эндометрия пациенток с ХЭ в период «окна имплантации» не может быть в полной мере корректным и несет, в большей степени, информацию о соответствии морфологических превращений эндометрия фазе менструального цикла.
Продолжают обсуждаться морфологические критерии ХЭ. В публикациях ряда исследователей диагноз хронического эндометрита связывают с детекцией плазматических клеток, другие авторы считают, что есть формы эндометритов, проявляющиеся только лимфоидной инфильтрацией, третьи допускают наличие плазматических клеток в эндометрии здоровых фертильных женщин, четвертые важнейшим маркером воспаления в ткани эндометрия считают наличие большого числа макрофагов. Некоторые исследователи предлагают проведение количественной оценки клеточных элементов инфильтрата. Изменения морфологических свойств эндометрия при хроническом эндометрите указывают на иммунные механизмы прогрессирования заболевания.
Таким образом, для морфологических проявлений хронических воспалительных заболеваний гениталий характерны общие признаки, возникающие в большинстве органов при хроническом воспалении. Однако трактовать их следует с учетом структурных и функциональных особенностей эндометрия. Метод иммуногистохимии дает развернутое представление о местных иммунных процессах.
Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, препятствуя нормальной имплантации и плацентации и формируя патологический ответ на беременность. Воспалительные структурные изменения вызывают нарушение пролиферации и нормальной циклической трансформации ткани эндометрия это приобретает особое значение при беременности после переноса криоконсервированных эмбрионов с заведомо низким жизненным потенциалом. Отмечается высокая корреляция ХЭ с неудачами программ ЭКО и репродуктивных потерь в циклах ВРТ.
Помимо рецептивности эндометрия важное значение в процессе имплантации играет сосудистый и гемостазиологический статус как в целом организме, так и в области формирования плацентарной площадки. Известно, что в процессе имплантации наблюдается нарушение целостности сосудов эндометрия, а присоединяющиеся при этом гемостазиологические отклонения от нормы способны приводить к нарушению процессов плацентации, что ведет к невынашиванию, неразвивающейся беременности, развитию различных патологических отклонений у плода и, в конечном итоге, к бесплодию. Известно, что стимуляция суперовуляции в процессе экстракорпорального оплодотворения сопровождается явлениями гиперкоагуляции и активацией внутрисосудистого свертывания. В этой связи представляется весьма актуальным изучение развернутой картины системы гемостаза с точки зрения влияния этой системы на результативность программы экстракорпорального оплодотворения. Не вызывает сомнений эффективность применения НМГ и высоких доз фолиевой кислоты во время беременности у женщин с АФС и генетически-обусловленными тромбофилическими состояниями.
В связи с изложенным становится очевидным необходимость выявления значимых диагностических критериев и внесения патогенетически обоснованных уточнений в структурно-функциональные изменения эндометрия, препятствующие реализации репродуктивной функции у женщин с хроническими воспалительными заболеваниями гениталий. Разнородность когорт пациенток, вступающих в программы ВРТ, заставляет клиницистов оценивать частоту и характер внутриматочных патологий в каждом конкретном медицинском учреждении для того, чтобы разработать индивидуальную программу подготовки эндометрия, перед проведением очередной программы ВРТ.
Считается, что 1 из каждых 7 пар во всем мире имеют проблемы бесплодия. Бесплодие оказывает глубокое психологическое и социальное влияние и сегодня лечение способно помочь Вам, воплотить свою мечту о рождении ребенка.
Репродуктивный Центр Медицины и Бесплодия Турции предлагает комплексный подход на основе фактических данных к диагнозу и лечение бесплодия, наша отзывчивая команда поможет Вам с каждым шагом пройти этот путь!
Обширный процесс тестирования и оценки выполняется, чтобы точно определить репродуктивные проблемы и соответственно разработать решения. Одно из этих решений - оплодотворение в пробирке (ЭКО) и передовые новшества, репродуктивная работа специалистов технологий ЭКО, достигла большего успеха чем когда-либо прежде. Воспроизводство выполняется с предварительным генетическим тестированием: для диагноза генетической болезни в ранних эмбрионах до оплодотворения и беременности.
Первичная цель состоит в том, чтобы предотвратить передачу генетических
составляющих, которые вызывают серьезную болезнь у детей от родителей, которые или поражены болезнью или являются носителями. Генетическая Диагностическая Лаборатория является известным центром, снабженным самой продвинутой технологией и экспертизой.
Один из центров в Турции является не только оказывающим репродуктивные услуги, но также и “национальным учебным центром”. Больнице был присвоен статус турецким Министерством здравоохранения как “Учебный центр IVF”. Интенсивная программа снабжает эмбриологов технической экспертизой и самыми продвинутыми медицинскими ноу-хау. При завершении б-месячной программы участники получают “Свидетельство об Обучении”, которые позволяют им работать в центрах IVF и лабораториях.
Врачи Репродуктивного Центра Медицины и Бесплодия получили обучение и сделали исследование в мировых известных центрах в Великобритании и Германии. Специалисты говорят на многих языках, включая английский, русский, немецкий и арабский языки.
Репродуктивные Центры Медицины и Бесплодия предлагают следующие услуги:
Клинические Услуги:
• Индукция овуляции
• Управляемое яичниковое гипервозбуждени< и внутриматочное оплодотворение (IUI)
• Хирургия бесплодия
• Хистеросалпингография
• Солевая сонография вливания
• Диагностическая лапароскопия
• Лапароскопия (эндометриоз хирургия, миомектомия, сальпингектомия, яичниковая хирургия кисты)
• Гистероскопия(полипектомия, пересекция перегородки, миомектомия, отделение внутриматочного прилипания)
Лабораторные Услуги:
• Микроинъекция
• Стандарт (ЭКО) и интрацитоплазматическая инъекция спермы (ICSI)
• Методы микроманипуляции (наблюдение эмбрионов через фрагменты)
• Хирургия бесплодия
• Генетическое тестирование перед оплодотворением
• Эндометриальная со-культура
• TESE-микроразбор (Micro-TESE)
• Замораживание эмбриона (также методами витрификации)
• Спермограмма (анализ спермы)
• Морфологический анализ спермы (согласно критериям Kruger)
• Анализ фрагментации ДНК спермы
Центр Экстракорпорального Оплодотворения (ЭКО) Здравоохранительной Группы предлагает свои услуги и дает надежду парам во всем мире.
Что Такое Ребёнок из Пробирки?
Ребёнок из Пробирки - искусственный метод слияния женских половых клеток - яйцеклеток, и мужских половых клеток - сперматозоидов, вне организма человека, в лабораторных условиях, который приводит к оплодотворению. Первый этап развития проходит в лабораторных условиях: оплодотворённые яйцеклетки начинают делиться, превращаясь в эмбрион, и затем помещаются в полость матки матери. Последующие этапы возникшей беременности не отличаются от беременности, возникшей естесственным путём. Отличие от естесственной беременности заключается в том, что оплодотворение происходит в лабораторных условиях, и оплодотворённые клетки снова помещаются в полость матки матери.
Процесс оплодотворения в лабораторных условиях производится путём добавления сперматозоидов к яйцеклеткам, которые самостоятельно проникают в яйцеклетки, когда необходимо ждать осуществления оплодотворения, (классический способ искусственного оплодотворения - ЭКО), либо путём непосредственого введения сперматозоида в яйцеклетку под микроскопом, при помощи пипетки, способствуя оплодотворению (микроинъекция). Специалисты определяют выбор между двумя методами в соответствии с индивидуальными особенностями семейной пары. Целью является добиться как можно больше шансов на успех для пары.
Кому Необходимо Искусственное Оплодотворение?
1. При непроходимости, серьёзных повреждениях, либо удалении хирургическим путём фаллопиевых труб, известных как яйцеводы, применяется экстракорпоральное оплодотворение. Для возникновения беременности естественным путём необходимо, чтобы яйцеводы женщины были проходимы и функционировали нормально.
2. В случае наличия спаек в области репродуктивных органов женщины, для того, чтобы избежать задержки в фаллопиевых трубах, развивающихся в яичниках яйцеклеток, может потребоваться экстракорпоральное оплодотворение. Эти спайки могут быть связанны с проведёнными ранее операциями в этой области (например, удаление кисты яичника, удаление миомы, удаление внематочной беременности ...) либо с воспалением внутренней половой системы женщины, которое, возможно, прошло незаметно.
В этом случае на первом этапе лечения проведётся попытка
обеспечить нормальные отношения между трубами и яичниками путём удаления этих спаек при помощи лапароскопической (закрытой) хирургии. Если это обеспечить невозможно, или, несмотря на то, что это обеспеченно, в течение определённого времени после хирургического вмешательства беременность не наступит, необходимо перейти к искусственному оплодотворению.
Женщина 28 лет... 4 года замужем. Несмотря на то, что не предохраняется, детей не имеет. Изучение снимка матки (ГСГ) показало, что трубы проходимы. Но врач высказал подозрение на то, что в результате операции по-удалению лопнувшего аппендицита, перенесённой в 18 лет, в области труб и яичников возможно наличие спаек. При проведении лапароскопического обследования выяснилось, что несмотря на то, что трубы проходимы, они оказались приклеены к кишечнику, яичникам и задней стенке матки. Трубы были проходимы, но не могли выполнять свои функции. Врач отправил пациетку на искусственное оплодотворение.
3. Если у женщины имеются проблемы с овуляцией, и несмотря на лечение препаратами, обеспечивающими овуляцию, беременность не наступила, необходимо перейти к искусственному оплодотворению. Важную часть этой группы составляют женщины с синдромом поликистоза яичников.
3. При наличии у женщины эндометриоза может потребоваться искусственное оплодотворение. Эндометриоз - в обычных условиях находящийся внутри матки и выделяющийся каждый месяц во время менструации эндометрий располагается вне полости матки, на маточных трубах, яичниках и кишечнике. Эндометриоз препятствует возникновению беременности. Если в течение определённого периодапосле хирургического удаления данного заболевания беременность не наступает, переходят к искусственному оплодотворению.
4. При недосточном колличестве сперматозоидов, низкой подвижности сперматозоидов и повреждении формы сперматозоидов (морфологии сперматозоидов) может понадобиться искусственное оплодотворение. В настоящее время применение метода «ребёнок из пробирки» (ЭКО)/ микроинъекции, самый успешный способ лечения мужского бесплодия, дающий самый высокий показатель беременности. При раннем обращении к методу искусственного оплодотворения у пар с мужским бесплодием повышается шанс на успех.
5. При отсутствии сперматозоидов в анализе спермы мужчины, можно добиться результата при помощи искусственного оплодотворения. Так как в этом случае сперматозоиды будут получены хирургическим путём из яичка или придатка яичка, единственным методом лечения, которое необходимо провести, является искусственное оплодотворение/микроинъекция.
Мужчина 32 лет. 10 лет женат. Все проведённые анализы спермы показывают, что колличество сперматозоидов и их подвижность ниже нормы. Его жене 4 раза давали различные препараты и проводилась инсеминация (ВМИ). Наблюдающий врач заявил, что пока у него жена молодая, самым подходящим будет перейти к методу ЭКО.
6. При бесплодии, которое невозможно объяснить, может потребоваться экстракорпоральное оплодотворение. ЭКО является подходящим выбором для семейных пар с необъяснимым бесплодием, совершивших попытки завести ребёнка естесственным путём, у которых на осмотре и обследованиях не выявлено никаких отклонений. Хотя у таких пар всегда есть шанс наступления беременности естесственным путём, с годами и изменением возраста жещины этот шанс заметно уменьшается. У таких пар ЭКО является успешным и в самое короткое время исчезает стресс и напряжённость.
Все проведённые анализы и исследования оказались нормальными. Врачи сказали, что всё в порядке и нет причин, препятствующих возникновению беременности. Прошло ещё 2 года, и результат отсутствовал. С целью повышения ежемесячного шанса на беременность, врачи приступили к проведению стимуляции созревания яйцеклеток (индукция овуляции) + внутриматочной инъекции (интраутериновая инсеминация). Лечение, проведённое 4 раза, не дало результатов. Пара приступила к ЭКО. Беременность наступила после первой попытки.
8. При иммунологическом бесплодии можно добиться успеха путём искусственного оплодотворения/микроинъекции. В сперме или репродуктивой системе женщины развиваются антиспермальные антитела, и если другие способы лечения безуспешны, необходимо обратиться к ЭКО.
9. Если речь идёт о позднем возрасте женщины, необходимо подумать об ЭКО. Способность к деторождению ослабевает с годами. Особенно после 35 лет ослабевание набирает скорость.Поэтому, особенно после 38 лет женщинам, желающим иметь детей, не теряя времени необходимо обратиться к ЭКО. Безвозвратная потеря времени на другие способы лечения бесплодия может очень дорого стоить женщинам в этом возрасте. В этот период, когда идёт борьба со временем, самым верным выбором может стать ЭКО.
10. В случаях, когда необходима предимплантационная генетическая диагностика, следует проводить ЭКО.
Экстракорпоральное оплодотворение стало главным выбором лечения при многих заболеваниях. Высокий уровень успеха ЭКО поставил этот метод с самого последнего способа, к которому обращались при лечении бесплодия на самое первое место среди методов лечения бесплодия. Переход ЭКО на первое место на раннем этапе спасает многие пары от напряжения и проблемы оставаться бездетными на протяжении многих лет.
Какие у Вас Шансы при ЭКО?
Успех проведения ЭКО заключается в том, что по-окончании 9 месяцев лечения вы сможете вернуться домой с живым и здоровым ребёнком.
Говоря о шансах на успех при проведении ЭКО, необходимо сказать о ваших шансах родить живого ребёнка. Иногда, говоря об уровне успешного оплодотворения, центры ЭКО берут за основу высокий уровень беременности, показанный анализом крови, в результате проведенного лечения. Но наличие беременности, показанное анализом крови не значит, что эта беременность продлится до родов. В некоторых случаях, несмотря на то, что анализ крови показывает наличие беременности, при ультразвуковом обследовании её невозможно определить, и показатель беременности в крови постепенно падает и исчезает (биохимическая беременность). Или, даже если ранняя стадия беременности наблюдается, ребёнок с сердцебиением может не развиться.
Поэтому, оценивая шансы на успех ЭКО и читая по-этому поводу прессу, необходимо принимать во внимание, сколько начавшихся попыток лечения завершилось здоровыми родами.
В 2000 году в США провели сравнение процентности беременности на каждый перенос эмбриона при искусственном оплодотворении.
Возраст Женщины Процентность Беременности
<35 44.2
35-37 39.8
38-40 32.4
41-42 22.6
>42 13.1
Факторы Влияют на Успех ЭКО?
Возраст женщины: Во всех случаях обращения к методу ЭКО, включая мужской фактор, одним из самых важных факторов, влияющих на успех искусственного оплодотворения является возраст женщины. Возможно, из-за проблем мужчины у пары на протяжении многих лет не наступила беременность, но приступая к искусственному оплодотворению выясняется важность возраста женщины.
Резерв яйцеклеток женщины (запас): Этот аспект, определяемый при различных гормональных и ультразвуковый исследоваиях, до приступления к ЭКО может повлиять на результат лечения.
Причина бесплодия, вынуждающая обратиться к ЭКО. Различные исследования показали, что уровень успеха ЭКО изменяется в зависимости от причины бесплодия.
Качество мужских и женских клеток.
Оптимальное проведение стимуляции яичников женщины во время курса ЭКО.
Качество и компетентность лаборатории по ЭКО.
Колличество неудачных искусственных оплодотворений, проведённых ранее: исследования показывают, что первые четыре попытки, проведённые в специализированном центре, имеют одинаковые шансы на успех, при последующих попытках шансы на успех снижаются.
С опытными специалистами у пациентов возможность наступления беременности на каждую попытку составляет до %50-60. В результате трёх попыток шанс на наступление беременности достигает %75-80. Если учесть, что ежемесячные шансы здоровой пары на возникновение беременности составляют %20, это очень большой успех.
То, что Вас больше всего интересует об искусственном оплодотворении
Сколько Продлится Моё Лечение Методом Искусственного Оплодотворения?
Продолжительность лечения методом искусственного оплодотворения изменяется для каждой пары, в зависимости от протокола, который врач считает подходящим для данной пары. Обычно продолжительность лечения составляет 15-25 дней (срок от начала применения препаратов до перемещения эмбриона).
Потребуется ли мне лежать в Больнице на протяжении Лечения? Нет. Только после извлечения яйцеклеток и после перемещения эмбриона вам достаточно отдохнуть в больнице 3-4 часа.
Буду ли я испытывать сильную боль при извлечении яйцеклеток? Нет. Напротив, процесс извлечения яйцеклеток у большинства пациентов проводится очень легко. Кроме того, во время этого процесса даются успокоительные и болеутоляющие препараты, а иногда процесс проводится под общей анестезией.
Когда Я Смогу Отправиться в Дорогу после Проведения Переноса? Если ваш дом находится не в том городе, где цетр, в котором проводится лечение, проведите день переноса эмбриона в этом городе, а на следующий день можете отправляться в дорогу.
После Перемещения Эмбриона до Проведения Анализа на Беременность Мне Следует Лежать?
Нет. Если вы не испытываете какой-либо боли, и хорошо себя чувствуете, вам не обязательно проводить время лёжа. На следующий день после проведения перемещения вы можете вернуться к повседневной жизни.
Вредны ли для Меня Препараты, Используемые во Время Лечения?
Указаний о том, что препараты, используемые во время лечения, вызывают рак яичников или какие-либо другие виды рака не имеется. У данных препаратов нет таких побочных эффектов, как продолжительное увеличение веса. Кроме того, они не используют яйцеклетки в яичниках, что вызвало бы у женщины раннюю менопаузу. Единственная проблема, связанная с препаратами, заключается в том, что иногда в результате чрезмерной стимуляции яичников развивается «синдром гиперстимуляции яичников».
Здоровы ли Дети, Родившиеся в Результате Искусственного Оплодотворения?
В вопросах физических отклонений, врождённых недостатков и генетических отклонений у детей, родившихся в результате искусственного оплодотворения, нет заметных отличий от детей, родившихся естесственным путём.
Если ЭКО/ микроинъекция проводится из-за низкого колличества сперматозоидов либо отсутствия сперматозоидов в сперме, паре следует проконсультироваться у врача-генетика, так как у мужчин в таком положении могут наблюдаться некоторые генетические проблемы, и хотя риск передать их новому поколению невелик, всё же это возможно.
Есть ли Побочные Эффекты у Препаратов, Применяемых во Время Лечения?
У препаратов, применяемых для подавления яичников возможны такие побочные эффекты, как приливы жара, головная боль, сухость влагалища, перепады настроения. Вам необходимо знать, что эти побочные эффекты временные, и пройдут с началом применения препаратов для стимуляции развития яицеклетки. У препаратов для стимуляции развития яйцеклетки возможны такие побочные эффекты, как покраснение и боль в области инъекции, чувствительность молочных желез, усталость, боль в паху и напряженность.
Каков Риск при Искусственном Оплодотворении?
1. Чрезмерная Стимуляция Яичников. Хотя это состояние может„ показаться несерьёзным оно может вызвать серьёзные беспокойства. Серьёзная форма, способная подвергнуть риску пациентку, встречается в% 1-2 случаев. В этом случае наблюдается вздутие живота, затруднённое дыхание, тошнота - рвота, задержка мочеиспускания, и боли в животе.
2. Возможно, самый большой риск - это многоплодная беременность. В связи с увеличением колличества эмбрионов, есть риск возникновения двоини - троини- четверни. Это серьёзно повышает риск преждевременных родов, и может вызвать различные проблемы детей в новорожденный период и в дальнейшем.
3. Хоть и крайне редко, но в процессе извлечения яйцеклетки в результате повреждения кровеносных сосудов может наблюдаться внутреннее кровотечение в брюшной полости или возниковение тазовой инфекции по-окончании процедуры.
4. В результате какого-либо отклонения на любом этапе лечения, лечение может быть приостановленно.
Высокий ли Риск выкидыша При Искусственном Оплодотворении?
Нет. Каков риск выкидыша при беременности, наступившей естесственным путём, таков же риск и при беременности, наступившей в результате искусственного оплодотворения.
Предимплантационная Генетическая Диагностика Что Такое Предимплантационная Генетическая Диагностика (ПГД) В центрах проведения ЭКО прежде, чем переместить эмбрионы в полость матки, проводится сканирование эмбрионов на врождённые-генетические болезни. Этот метод называется «предимплантационной генетической диагностикой». Суть этого метода заключается в том, что парам с риском рождения ребёнка с врождёнными-генетическими заболеваниями проводится искусственное оплодотворение и обеспечивается развитие большого колличества эмбрионов, после чего среди них выбираются незатронутые эмбрионы. У полученных эмбрионов берётся проба одной или двух клеток, и выбираются эмбрионы, не несущие врождённых заболеваний. Здоровые эмбрионы переносятся в полость матки матери.
В каких случаях применяется?
У будущих мам и пап, являющихся носителями генетических нарушений следующих болезней:
• Талассемия (Средиземноморская анемия),
• Серповидноклеточная анемия,
• Кистозный фиброз,
• Болезнь Тея-Сакса,
• Гемофилия А и Б,
• Пигментный ретинит,
• Отоокулоренальный синдром,
• Нехватка альфа -1-антитрипсина,
• Фрагильный Х-синдром,
• Фенилкетонурия,
Определение пола определение пола эмбрионов и помещение в полость матки эмбрионов желаемого пола производится лишь в случае медицинской необходимости. Этот метод применяется с целью предотвращения переходящих Х-сцепленных врождённых заболеваний, так как риск возникновения некоторых заболеваний передаётся только одному полу.
Каков Процент ошибок при Данном Методе?
Возможность ошибочного результата данного метода зависит от опыта центра, в котором он применяется, при диагностике дефектов генов и численных хромосомных нарушений надёжность результата составляет % 97.
Каков Шанс на Успех Метода?
Шанс на успех метода высок. Развитие эмбрионов, у которых изъята одна или две клетки происходит нормальным образом, и обеспечивается уровень наступления беременности равный уровню успеха искусственного оплодотворения. Кроме того, считается, что у семейных пар с повторяющимися безуспешными попытками искусственного оплодлотворения, о которых говорилось выше, пар с нарушением спермы и мужским бесплодием, пар с женщиной позднего возраста и пар с повторяющимися выкидышами уровень беременности превысит уровень успеха обычных ЭКО.
Вывод
Так как предимплантационная генетическая диагностика проводится ещё до того, как эмбрион помещается в полость матки, метод является чрезвычайно легким и приемлимым методом.
Таким образом, избегается неприятный для будущей мамы и всей семьи период взятия околоплодой жидкости, ткани или образца крови после наступления беременности и прерывания беременности в случае диагностики заболевания. Поэтому этот метод генетической диагностики является наиболее этичным и приемлемым.
Действия, Повышающие Шанс на Успешное Оплодотворение
• Тщательное обследование женщины перед ЭКО
• Хорошее контролирование овуляции.
• Выполненное с точностью перенесение эмбриона.
Из Каких Этапов Состоит ЭКО?
Процесс искусственного оплодотворения состоит из нескольких этапов.
Первый Этап: Обучение
Первый этап лечения состоит из обучения, которое проводит координатор искусственного оплодотворения. На этом этапе даётся информация о процедуре, рассказывается о плане лечения и способе его проведения, ведётся обучение самостоятельному использованию препаратов и подписываются необходимые документы.
Второй Этап: Подавление Яичников
Основа искусственного оплодотворения - взятие под полный контроль яичников женщины. Для этого используются препараты под названием GnRH агонист или GnRH антагонист. Лечащий врач
выберет среди них подходящий вам препарат.
Эти препараты препятствуют преждевременной овуляции. Препараты представляют собой либо спрей для носа либо подкожные инъекции. Вас обучат самостоятельному применению препаратов.
Третий Этап: Стимуляция яичников и контролирование развития яйцеклетки
Успех искусственного оплодотворения зависит от количества яйцеклеток, произведённых яичниками женщины. Для этого яичники, находящиеся под контролем при помоще указанных выше
препаратов, стимулируются препаратами, стимулирующими развитие яйцеклеток. Эти лекарства представляют собой подкожные или внутривенные инъекции. Стимуляция яичников данными
препаратами займёт приблизительно 10 дней. В течение этого времени необходимо несколько раз провести осмотр для того, чтобы проконтролировать развитие яйцеклеток. На этих обследованиях
проводится ультразвуковое исследование и в случае необходимости, на основании уровня гормонов у вас в крови, определяется в каком колличестве принимать препараты.
Четвёртый этап: Извлечение яйцеклеток
Во время контроля за развитием яйцеклетки, в день, когда будет замечено, что созрело достаточное количество яйцеклеток, окончательное созревание яйцеклеток обеспечивается проведением
инъекции чХГ (человеческий хориогонадотропин).
Извлечение яйцеклеток планируется на последующие после последней инъекции 36 часов. Извлечение яйцеклеток производится под действием обезболивающих препаратов или под
общим наркозом. Процедура похожа на вагинальное ультразвуковое исследование, проводимое при контроле за развитием яйцеклеток.
Единственная разница заключается в том, что к ультразвуковому аппарату прикрепляется игла, которая проходит через влагалище, извлекает яйцеклетки из яичников. Процесс в среднем занимает 30 минут. Оплодотворение яйцеклеток сперматозоидами производится в день извлечения яйцеклеток. Через 2-3 часа отдыха после извлечения яйцеклеток пару выписывают из больницы. Паре даётся информация о препаратах, которые будут применяться после данного этапа.
Пятый этап: Лабораторные процедуры
Через день после извлечения яйцеклеток паре сообщается сколько яйцеклеток оплодотворилось нормальным образом. Оплодотворённые яйцеклетки находятся в лаборатории под наблюдением в течение 2-5 суток, и в наиболее подходящий момент, выбрав среди них определённое колличество самых качественных яйцеклеток, помещают в полость матки матери. Паре сообщится о времени проведения данной процедуры.
Последний этап: Перенос эмбриона
Перед проведением переноса эмбрионов паре даётся иформация о колличестве эмбрионов и их качестве. Процесс переноса не отличается от простого осмотра. Нет необходимости в анестезии. Единственное требование перед проведением переноса заключается в том, что будущая мама должна выпить воды и наполнить мочевой пузырь. Так как перенос проводится под ультразвуковым наблюдением и для этого мочевой пузырь должен быть наполнен.
В процессе переноса катетер с эмбрионами, пройдя через влагалище и шейку матки, помещается в полости матки и эмбрионы оставляются внутри. Если после перемещения остаются качественный эмбрион или эмбрионы, получив разрешение пары, эти эмбрионы замораживаются и сохраняются, для использования в будущем.
Через 3-4 часа отдыха в больнице после процедуры, пара отправляется домой и женщина должна провести день отдыхая. Для поддержания развития беременности после извлечения яйцеклеток или переноса эмбрионов можно начать применение прогестерона, эстрогена и/или чХГ.
Результат лечения можно узнать через 14 дней после переноса, при помощи теста на беременность. Если результат окажется положительным, через три недели назначается ультразвуковое исследование для того, чтобы проследить за сердцебиением ребёнка.
Тест на беременность
Девочки-хочушки!
Прочитайте всю статью! Мне кажется для каждой она внесёт много-много ясности!
Тесты на беременность. Причины изменений уровня ХГЧ
Действие теста на определение ранней беременности основано на определении специфического гормона беременности - хорионического гонадотропина (ХГЧ), который начинает вырабатываться через 1 день после имплантации (прикрепления) оплодотворенной яйцеклетки к стенке матки.
Как происходит зачатие?
Созревание яйцеклетки и ее выход из яичника (овуляция) происходит примерно за 14 дней до начала менструации при 28-дневном менструальном цикле.
Оплодотворение этой яйцеклетки возможно примерно в течение 3 - 4 дней. По данным различных авторов, сроки оплодотворения могут быть от 12 - 24 часов до 7 суток. Выживаемость сперматозоидов в женском генитальном тракте зависит во многом от свойств семенной жидкости. Подвижность сперматозоидов сохраняется дольше, чем их способность к оплодотворению.
После оплодотворения яйцеклетка продвигается по маточной трубе в полость матки. Транспортировка зародыша по направлению к матке продолжается в течение 5 - 6 суток. Достигнув полости матки, оплодотворенная яйцеклетка в течение некоторого времени находится в свободном состоянии и на 6 - 7-е сутки внутриутробного периода прикрепляется («прилипает») к эпителию эндометрия, после чего начинает активно внедряться в слизистую матки (имплантируется).
С этого момента начинает развиваться беременность, что и отражается выработкой гормона беременности - хорионического гонадотропина. Таким образом, за несколько дней до ожидаемой менструации, в организме появляются следы ХГЧ, которые можно определить в моче домашними методами с 1-го дня задержки менструации.
В медицинских учреждениях проводят определение ХГЧ в крови, выявляя беременность за несколько дней до срока ожидаемой менструации, т.к. чувствительность «кровяного» метода гораздо выше.
Нормальный уровень ХГЧ в сыворотке крови (мЕд/мл):
Здоровые небеременные 0 - 15
Беременные
1 - 2 нед 19 - 145
2 - 3 нед 111 - 3 640
3 - 4 нед 1 090 - 17 600
4 - 5 нед 2 740 - 59 600
5 - 6 нед 23 500 - 137 000
6 - 7 нед 29 900 - 222 000
7 - 8 нед 30 500 - 266 000
8 - 9 нед 54 700 - 268 000
9 - 10 нед 25 900 - 234 000
10 - 11 нед 46 200 - 238 000
11 - 18 нед 16 500 - 92 700
18 - ... нед 8 540 - 58 500
Внимание! В различных лабораториях нормы могут отличаться.
Механизм «работы» теста на беременность
В тестах на беременность используется иммунохроматография - разновидность хроматографического анализа, основанная на взаимодействии определяемого вещества (обычно белковой природы) с антителами к нему. По такому же принципу взаимодействия антиген-антитело работает иммунная система организма, отсюда и название.
Определяемым веществом служит хорионический гонадотропин человека (ХГЧ) - гликопептидный гормон, выделяемый плацентой в течение беременности. Появление и быстрый рост концентрации ХГЧ в организме (и в частности, в моче) женщины делает его достаточно достоверным признаком беременности. Обычно, на 7-10-й день после оплодотворения, концентрация ХГЧ достигает 25 мМЕ/мл (международных единиц на мл) и удваивается каждые 2-3 дня, достигая максимума между 8-й и 11-й неделями беременности, а затем снижается практически до нуля к началу 3-го триместра. 25 мМЕ/мл - это минимальная концентрация ХГЧ, детектируемая с помощью иммунохроматографических тестов.
Тест-полоска содержит конъюгат (непрочное соединение) антител к ХГЧ с красителем. Когда образец мочи движется по абсорбирующей полоске, конъюгат связывается с ХГЧ и образует комплекс антиген-антитело. В зоне положительной реакции ("беременная полоска") комплекс связывается с анти-ХГЧ-антителами. При этом высвобождается краситель и образуется красно-розовая полоска. Если ХГЧ в образце отсутствует, никакой полоски, понятно, не образуется. Тем временем моча движется дальше, минует зону положительной реакции и достигает зоны отрицательной реакции ("контрольная полоска"). Там несвязанный конъюгат антитело-краситель связывается реагентами контрольной полоски, высвобождается краситель и образуется вторая (контрольная) полоска такого же красно-розового цвета. Все реакции происходят в течение 3-5, реже 7 мин.
В не слишком качественных тестах краситель может отщепляться от конъюгата раньше, чем весь комплекс антитело-ХГЧ-краситель достигнет реакционных зон, образуя расплывчатые пятна. Они-то чаще всего и принимаются за "ложноположительный" результат. Настоящие ложноположительные результаты встречаются гораздо реже и вызваны вполне конкретными причинами. Также слабая вторая полоска может проявиться, если "передержать" тест, т.е. считывать показания не через указанные на упаковке 5 минут, а позже. Такая линия возникает в результате испарения воды с поверхности теста, от чего разрушаются конъюгаты и высвобождается краситель. Так что не стоит ждать 10 мин вместо 5, чтобы "уж точно убедиться".
Поскольку точно выполнить все инструкции и правильно интерпретировать результаты теста может не каждая женщина, врачи, особенно старой закалки, не склонны доверять тестам.
Что определяет тест на беременность?
Тест на беременность определяет хорионический гонадотропин человека (ХГЧ) - гормон, выделяемый плацентой с момента имплантации эмбриона в стенку матки в течение всей беременности. Достоверность этого теста весьма высокая - нет плаценты, нет и ХГ. ХГЧ можно определять как в крови (в лаборатории), так и в моче (в лаборатории и дома)
На какой день после овуляции можно проводить тест?
В принципе, положительный результат можно получить уже на 7-й день после овуляции. На имплантацию эмбриона нужно 6-12 дней, обычно около 10 дней. Так что имеет смысл подождать 10-12 дней после овуляции, но даже и в этом случае часто бывают ложноотрицательные результаты (т.е., беременность есть, но тест отрицательный).
Тесты разных производителей имеют различную чувствительность, большинство из них рассчитаны на использование с 1-го дня задержки месячных. В 90% ± 5% случаев к этому времени эмбрион уже имплантируется в стенку матки и начинает вырабатывать ХГЧ. Однако в 10% случаев имплантации еще не произошло. При задержке в 1 неделю имплантация происходит уже в 97% ± 3% случаев. Однако на практике достоверность тестов ограничена их чувствительностью, так что реальная достоверность несколько ниже. Поскольку уровень ХГЧ удваивается каждые 2-3 дня, отсюда следует рекомендация: при отрицательном результате, если месячные не начнутся, повторить тест через несколько дней.
Что означают ложноположительные и ложноотрицательные результаты теста?
Ложноположительный результат - это когда тест показывает две полоски в отсутствие беременности. Так бывает, когда женщина принимает препараты, содержащие ХГЧ, а также при трофобластических опухолях. После самопроизвольного выкидыша или аборта на ранних сроках или удаления внематочной беременности ХГЧ в течение некоторого времени остается в организме, и тест дает ложноположительные результаты (т.е. беременности уже нет, а тест еще положительный). Как и в случае приема препаратов, содержащих ХГЧ, для получения достоверных результатов необходимо сделать два количественных определения ХГЧ с интервалом в 2-3 дня. Уменьшение уровня ХГЧ свидетельствует о том, что беременности уже нет. Таким образом, ложноположительные результаты - относительная редкость, в отличие от ложноотрицательных. Последние получаются тогда, когда срок беременности еще слишком мал и уровень ХГЧ слишком низок, чтобы его обнаружил тест (либо тест сам по себе недостаточно чувствительный).
Достоверность домашнего теста зависит от различных причин:
- Качество самого теста. Продукция разных фирм может значительно различаться.
- Срок годности теста, условия и место его хранения. Считается, что в большинстве случаев тесту можно доверять при условии, что он куплен в аптеке.
- Состояние беременности. При беременности, находящейся на грани выкидыша, ХГ будет вырабатываться гораздо меньше, чем при нормально развивающейся беременности.
- Условия постановки теста: исследование необходимо проводить, используя утреннюю порцию мочи, в которой наблюдается максимальное содержание гормона; оценку теста необходимо проводить, придерживаясь временного интервала, указанного в инструкции.
- Дополнительные обстоятельства. На содержание ХГ в моче влияет рацион и функциональное состояние ваших почек.
- Если накануне вечером вы выпили очень много жидкости или съели арбуз, или принимаете диуретики (мочегонные средства), концентрация гормонов в моче будет слишком низкой, и тест их "не заметит".
- Если у вас в моче присутствует белок (даже если вы об этом ничего не знаете) - тест может дать неправильный результат.
- Если вам вводили ХГЧ с целью индукции овуляции (препараты Профази, Прегнил) или для поддержания лютеиновой фазы, то следы этого гормона могут оставаться в вашем организме в течение 10 дней после последнего приёма препарата, и, соответственно, тест на беременность может дать ложноположительный результат.
- Также уровень ХГЧ может определяться через несколько недель после нормальных родов, кесарева сечения, спонтанного или медицинского аборта и в других случаях, указанных выше.
В результате можно получить неверную информацию, причем в обе стороны: беременности нет, но тест вроде бы положительный. Или: беременность есть, но тест пока отрицательный. И то, и другое бывает источником больших переживаний.
Здравствуйте!
Страдаю бесплодием 6,5 лет, ни дня не сидела на месте, а сейчас можно сказать зашла в тупик.