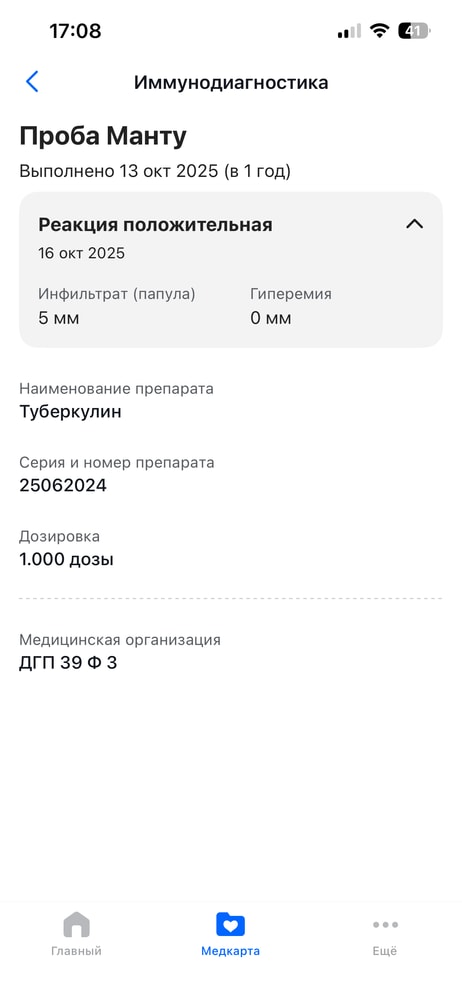

Здравствуйте!
пишу этот пост, чувствую большую усталость и некое беспокойство.
Малыш мальчик, 10 мес 3 недели. С рождения ОЧЕНЬ АКТИВНЫЙ.
У невролога были в 4 мес, все ок.
Что меня беспокоит (и бесит одновременно)): сын вообще не дает одеваться, и не лежит на спине! Как научился переворачиваться на живот, все..стоит только положить на спину, все сраз
Девочки, здравствуйте!
вводим прикорм мясной. Покупные баночки - это хорошо, но разориться можно). Как дома организовать заготовки мясных пюре? Можно ли заранее делать пюре и замораживать? Если замораживать, то в чем?
Это боль и кошмар! Нам 4 месяца, недели две как ужасный ночной сон. Днем еще более менее. Начал переворачиваться со спины на живот, обратно не умеет. За ночь может 3 раза просыпаться и пытаться переворачиваться (я его в пеленку кокон одеваю заранее) и по часу или два часа пыхтеть и никак его не уложишь, вот никак!!! Грудь, ручки, ни-че-го!!! Буд
Девочки, что это может быть..
родила в октябре 2024 года. А вот в январе сейчас после дефекации начала чувствовать явный зуд.. в декабре 17 дней пила антибиотики.. что это? Геморрой? Острицы? Дисбактериоз?
заметила, что после душа зуд уходит , если после туалета сразу подмыться
и заметила красноту на теле после геля для душа и
Добрый день!
Сейчас думаю, где вести беременность. У меня была замершая, есть поломки по гемостазу, среди самых грозных - гетеро гена F2
Поэтому нужен не просто грамотный гинеколог, но и гематолог/гемостазиолог. Цир не рассматриваю. Думаю о ведении у Шамановой Марии Борисовны, но ценник очень смущает в Мать и Дитя. Поделитесь,
Девушки, сдала первую КОА
срок 4 недели, 5 дней
наследственная тромбофилия по F2 гетеро, плюс по мелочи еще поломки
На клексане 0,4 с //, тромбо асс 100 с планирования и по сей день, медрол 4 мг - терапия
волнует сниженный антитромбин 3 - сейчас 76% про норме от 80%
до беременности в декабре был в норме), б
Девочки, привет! Срок 4 недели 5 дней
очень волнует динамика Хгч , если смотреть на сегодняшний день
27.01 - 12 (10 дпо)
29.01 - 46 (12 дпо)
31.01 - 169 (14 дпо)
Сегодня 05 февраля - Хгч 945 (20 дпо)
(первые три в одной лабе, сегодня в другой)
НО! Была на узи сегодня же - плодное
Девочки, кто вел/ведет беременность в мать и дитя в 2023 году и сейчас
Поделитесь , пожалуйста, вкратце
1) во сколько вышло по деньгам? знаю, у них есть депозитная система
2) у какого врача ведетесь? (У меня АФС, по гемостаза вопросы, в прошлом зб), думаю о ведении и МБ Шамановой
Спасибо 🙏🏻❤️
Всем добрый вечер :) Я уже много раз видела в ленте вопросы о гестационном сахарном диабете (ГСД), поэтому решила, что стоит поделиться опытом. Конечно, о беременности на фоне ГСД можно рассказывать бесконечно, но в этом посте хотелось бы указать конкретные шаги, которые обязательны при поставке такого диагноза, а вся лирика будет в следующем по